Nguyên tố đồng có hai đồng vị trong tự nhiên: Cu-63 và Cu-65. Biết khối lượng nguyên tử trung bình của Cu là 63,6 amu. Tính thành phần phần trăm mỗi đồng vị của đồng có trong tự nhiên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi phần trăm số nguyên tử của hai đồng vị \(^{63}_{29}Cu\) và \(^{65}_{29}Cu\) lần lượt là a và b.
Ta có: \(\left\{{}\begin{matrix}a+b=100\%\\63a\%+65b\%=63,54\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}a=73\%\\b=27\%\end{matrix}\right.\)
Phần trăm khối lượng \(^{63}_{29}Cu\) trong \(Cu\left(NO_3\right)_2\) là:
\(\dfrac{63\cdot0,73}{63,54+14\cdot2+16\cdot6}\cdot100\%=24,52\%\)

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
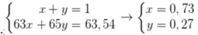
Phần trăm khối lượng của 63Cu trong Cu2O là
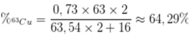

Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
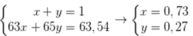
Phần trăm khối lượng của 63Cu trong CuSO4 là
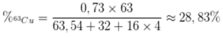

Ta có : nguyên tử khối trung bình của đồng được tính theo công thức :
63,54 = \(\frac{165+\left(100-a\right)63}{100}\)
Trong đó a là phần trăm số nguyên tử \(\frac{65}{29}Cu,q,\left(100-a\right)\) là phần trăm số nguyên tử \(\frac{63}{19}Cu\) . Giải ra ta có a = 27%
Vậy \(\frac{65}{29}Cu\) có 27% , \(\frac{63}{29}Cu\) có 73 %

Đáp án D
• Giả sử % của 63Cu, 65Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
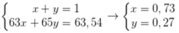
→ Phần trăm của 63Cu trong CuCl2 là
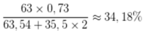

Gọi \(x\) là phần trăm đồng vị \(Cu-63\).
Ta có: \(\overline{M_{Cu}}=\dfrac{63x+65\left(100-x\right)}{100}=63,6\)
\(\Leftrightarrow x=73\left(\%\right)\)
Vậy đồng vị Cu-63 chiếm 73%, đồng vị Cu-65 chiếm 27%.