Đốt cháy hỗn hợp hai hidrocacbon đồng đẳng kế tiếp nhau thu được 11.7g H2O và 17.6g CO2.Xác định CTPT của hai hidrocacbon trên.Tính % khối lượng mỗi ankan trong hỗn hợp.?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CO_2}=\dfrac{48,4}{44}=1,1\left(mol\right)\\ n_{H_2O}=\dfrac{29,7}{18}=1,65\left(mol\right)\\ Vì:n_{H_2O}>n_{CO_2}\Rightarrow hhZ:hh.ankan\\ CTTQ:C_aH_{2a+2}\\ Ta.có:1< \dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{1,65}{1,1}=1,5< 2\\ \Rightarrow hh.Z:50\%V_{CH_4},50\%V_{C_2H_6}\\ \Rightarrow\%m_{\dfrac{CH_4}{hhZ}}=\dfrac{16}{16+28}.100\approx36,364\%\\ \Rightarrow\%m_{\dfrac{C_2H_6}{hhZ}}\approx63,636\%\)

nCO2 = 0,4 mol
nH2O = 0,65 mol
nH2O > nCO2 => ankan
CTB = 0,4/0,25 = 1,6 => CH4 và C2H6

Ta có: nH2O = 0,65 > nCO2 = 0,4
=> 2 hiđrocacbon cần tìm là ankan ( Vì khi đốt cháy ankan thì thu được mol H2O>CO2)
=> nAnkan = nH2O - nCO2 = 0,25
=> Ctb = 0,4/0,25 = 1,6
Vậy 2 ankan cần tìm là CH4 và C2H6

Giả sử trong 18,9 g hỗn hợp X có x mol ancol etylic và y mol hai ankan (công thức chung C n H 2 n + 2 ).
46x + (14 n + 2)y = 18,90 (1)
C 2 H 5 O H + 3 O 2 → 2 C O 2 + 3 H 2 O
x mol 2x mol 3x mol
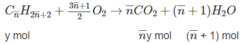
Số mol
C
O
2
= 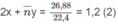
Số mol
H
2
O
= 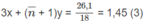
Giải hệ phương trình (1), (2), (3) tìm được x = 0,1 ; y = 0,15 ; n = 6,6
Công thức của hai ankan là C 6 H 14 và C 7 H 16 .
Đặt lượng C 6 H 14 là a mol, lượng C 7 H 16 là b mol :
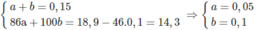
% về khối lương của
C
6
H
14
: 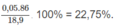
% về khối lượng của
C
7
H
16
: 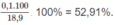

Gọi công thức chung của X, Y là CnH2n+2
\(n_{O_2}=\dfrac{36,8}{32}=1,15\left(mol\right)\)
PTHH: CnH2n+2 + \(\dfrac{3n+1}{2}\)O2 --to--> nCO2 + (n+1)H2O
\(\dfrac{2,3}{3n+1}\)<-----1,15
=> \(M_{C_nH_{2n+2}}=14n+2=\dfrac{10,2}{\dfrac{2,3}{3n+1}}\left(g/mol\right)\)
=> n = 3,5
Mà X,Y là 2 ankan kế tiếp nhau
=> X, Y là C3H8 và C4H10
Gọi số mol C3H8 và C4H10 là a, b (mol)
PTHH: C3H8 + 5O2 --to--> 3CO2 + 4H2O
a--->5a---------->3a----->4a
2C4H10 + 13O2 --to--> 8CO2 + 10H2O
b------->6,5b--------->4b------>5b
=> \(\left\{{}\begin{matrix}44a+58b=10,2\\5a+6,5b=1,15\end{matrix}\right.\)
=> a = 0,1; b = 0,1
=> \(\left\{{}\begin{matrix}m_{C_3H_8}=0,1.44=4,4\left(g\right)\\m_{C_4H_{10}}=0,1.58=5,8\left(g\right)\end{matrix}\right.\)
\(n_{CO_2}=3a+4b=0,7\left(mol\right)\)
=> \(m_{CO_2}=0,7.44=30,8\left(g\right)\)
\(m_{H_2O}=\left(4a+5b\right).18=16,2\left(g\right)\)

$n_{CO_2} = 0,7(mol) ; n_{H_2O} = 0,8(mol)$
$n_A = n_{H_2O} - n_{CO_2} = 0,8 - 0,7 = 0,1(mol)$
$n_B = \dfrac{6,72}{22,4} - 0,1 = 0,2(mol)$
Bảo toàn nguyên tố với C :
$n_{CO_2} = 0,1n + 0,2m = 0,7$
Với n = 3 ; m = 2 thỉ thỏa mãn
Với n = 1 ; m = 3 thì thỏa mãn
Vạy A và B có thể là $C_3H_8,C_2H_4$ hoặc $CH_4,C_3H_6$

bài 1
Đốt cháy hoàn toàn V lít (đktc) hỗn hợp 2 hidrocacbon là đồng đẳng liên tiếp nhau, sản phẩm cháy thu được có tỉ lệ thể tích CO2 và H2O là 12 : 23. Tìm CTPT và % thể tích của mỗi hidrocacbon
Ta có nCO2nCO2 < nH2OnH2O ---> hỗn hợp gồm hai hidrocacbon no, mạch hở
Cx¯H2x¯+2
ta có : x¯/12=x¯+1/23---> x¯=1,1
hỗn hợp gồm: CH4, C2H6
Tính % thì dùng sơ đồ đường chéo
C1------------------0,9
---------1,1----------
C2------------------0.1
CH4: 90%
C2H6: 10%
bài 2
Đốt cháy hoàn toàn 29,2g hỗn hợp 2 ankan A và B. Sản phẩm sinh ra cho vào dung dịch Ba(OH) 2 thấy khối
lượng bình tăng thêm 134,8g.
a. Tính khối lượng CO2 và H2O tạo thành khi đốt 2 ankan.
b. Nếu A, B là đồng đẳng kế tiếp, tìm CTPT A,B.
a) Gọi a,b lần lượt là số mol CO2, H2O
=> 44a + 18b = 134,8 (1)
Ta có : nC = nCO2 = a mol; nH = 2nH2O = 2b mol
=> 12a + 2b = 29,2 (2)
(1),(2) => a = 2; => mCO2 = 88g
b = 2,6 => m H2O = 46,8g
b,m oxi phản ứng là 134,8 - 29,2 = 105,6
số mol của oxi là : 105,6/32 =3,3 mol
gọi cong thức chung của 2 ankan là CnH2n+2 +(3n+1)/2 O2 => nCO2 + (n+1) H2O
số mol của CnH2n+2 = 3,3 chia cho (3n+1)/2 =6,6/(3n+1)
=> (14n +2) x 6,6/(3n+1) =29,2
=> n =3,3
=> C3H8 và C4H10
Bài 3 :
Theo đề bài ta có : nH2O = 10,8/18 = 0,6 (mol) ; nCO2 = 15,4/44 = 0,35 (mol) ;nhh=0,25(mol)
ta thấy : nH2O > nCO2 => 2 hidroccacbon là ankan
=> số \(\overset{_-}{C}\) = 0,35/0,25 = 1,4 => 2 ankan là CH4(x) và C2H6(y)
Theo BTNT C có : x + 2y = 0,35 ;(1)
Thep BTNT H có : 2x + 3y = 0,6 ;(2)
từ (1) và (2) => x = 0,15;y=0,1 => %VCH4 = (0,15/0,25).100=60%;%VC2H6=40%
\( n_{H_2O} = \dfrac{11,7}{18} = 0,65\ mol\\ n_{CO_2} = \dfrac{17,6}{44} = 0,4\ mol\\ \Rightarrow Hidrocacbon :\ C_nH_{2n+2}\\ n_{hidrocacbon} = n_{H_2O} - n_{CO_2} = 0,65 - 0,4 = 0,25(mol)\\ \Rightarrow n = \dfrac{n_{CO_2}}{n_{hidrocacbon}} = \dfrac{0,4}{0,25} = 1,6\\ 1< n=1,6<2\Rightarrow Hidrocacbon:\ CH_4,C_2H_6\\ n_{CH_4} = a\ mol ; n_{C_2H_6} = b(mol)\\ \Rightarrow a + b = 0,25 ; n_{CO_2} =a + 2b = 0,4\\ \Rightarrow a = 0,1 ; b = 0,15\\ \Rightarrow \%m_{CH_4} = \dfrac{0,1.16}{0,1.16+0,15.30}.100\% = 26,23\%\)
\(\%m_{C_2H_6} = 100\% - 26,23\% = 73,77\%\)