Cho 22,4 g Fe tác dụng vừa đủ với 200 g ddịch H2SO4 loãng. Nồng độ % dd axit đã phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) Gọi x,y là số mol Al, Fe
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Ta có hệ : \(\left\{{}\begin{matrix}27x+56y=0,83\\\dfrac{3}{2}x+y=0,02\end{matrix}\right.\)
=> \(x=\dfrac{29}{5700};y=\dfrac{47}{3800}\)
\(\%m_{Al}=\dfrac{\dfrac{27}{5700}.27}{0,83}.100=16,55\%\); \(\%m_{Fe}=100-16,55=83,45\%\)
c)Bảo toàn nguyên tố H: \(n_{H_2SO_4}=n_{H_2}=0,02\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,02.98}{200}.100=0,98\%\)

Câu 4:
Tính khối lượng của H2SO4 có trong dung dịch:
m = n x M x V
Trong đó:
n = 0,4 mol (số mol của H2SO4)
M = 98g/mol (khối lượng mol của H2SO4)
V = 200g (thể tích của dung dịch)
m = 0,4 mol x 98g/mol x 200g / 1000g = 7,84g
% = (khối lượng H2SO4 / khối lượng dung dịch) x 100 % = (7,84g / 200g) x 100 = 3,92% Vậy nồng độ % của dung dịch axít đã phản ứng là 3,92%.
C6
Mg + 2HCl -> MgCl2 + H2
m = n x M
n = m / M
Trong đó:
m = 9,6g (khối lượng của Mg)
M = 24,31g/mol (khối lượng mol của Mg)
n = 9,6g / 24,31g/mol = 0,395 mol
Mg + 2HCl -> MgCl2 + H2
Tỷ lệ phản ứng của Mg và HCl là 1:2, vì vậy số mol của HCl là 2 x 0,395 mol = 0,79 mol.
Để tính khối lượng của dung dịch sau phản ứng, ta cần biết khối lượng riêng của dung dịch HCl. Với dung dịch HCl có nồng độ 36,5%, khối lượng riêng xấp xỉ là 1,18 g/mL.
V = m / rho
V = 120g / 1,18 g/mL = 101,69 mL (thể tích của dung dịch)
m (HCl) = 0,79 mol x 36,5g/mol = 28,835 g (khối lượng của HCl sau phản ứng)
M (dung dịch sau phản ứng) = m + M(H2O) = 28,835g + 72g = 100,835g
% = (khối lượng chất tan / khối lượng dung dịch) x 100
% = (28,835g / 100,835g) x 100 = 28,62%
Vậy nồng độ phần trăm của dung dịch sau phản ứng là 28,62%.

a,\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.0,4=0,2\left(mol\right)\)
PTHH: 2K + 2H2O ---> 2KOH + H2 (Fe và Cu ko tan trong nước)
0,2 0,1
Fe + 2HCl ---> FeCl2 + H2 (Cu ko phản ứng với HCl)
0,1 0,2
mChất rắn còn lại = mCu = 6,6 (g)
\(\rightarrow\left\{{}\begin{matrix}m_K=39.0,2=7,8\left(g\right)\\m_{Fe}=56.0,1=5,6\left(g\right)\\m_{Cu}=6,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow m_{\text{hhkimloại}}=7,8+5,6+6,6=20\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_K=\dfrac{7,8}{20}=39\%\\\%m_{Fe}=\dfrac{5,6}{20}=28\%\\\%m_{Cu}=100\%-39\%-28\%=33\%\end{matrix}\right.\)
b, PTHH: FexOy + yH2 --to--> xFe + yH2O
\(n_{O\left(\text{trong oxit}\right)}=n_{H_2O}=n_{H_2}=0,1\left(mol\right)\\ \rightarrow n_{Fe\left(\text{trong oxit}\right)}=\dfrac{5,8-0,1.16}{56}=0,075\left(mol\right)\)
\(\rightarrow x:y=n_{Fe}:n_O=0,075:0,1=3:4\)
CTHH của oxit sắt Fe3O4
Sửa đề thành 2,24 l khí C nhé :)

200ml = 0,2l
\(n_{KOH}=1.0,2=0,2\left(mol\right)\)
Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O|\)
2 1 1 2
0,2 0,1
\(n_{H2SO4}=\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
⇒ \(m_{H2SO4}=0,1.98=9,8\left(g\right)\)
\(C_{ddH2SO4}=\dfrac{9,8.100}{49}=20\)0/0
Chúc bạn học tốt

Đầu tiên bạn tính n H2 = cách bảo toàn e =» n hcl pư =» m dd hcl pư
Bạn bảo toàn ntố Fe để tím n FeCl2 =» m FeCl2 (dd B)
C% dd B = m FeCl 2 / (m Fe + m dd HCl)

Khối lượng của bari clorua
C0/0BaCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{10,4.200}{100}=20,8\left(g\right)\)
Số mol của bari clorua
nBaCl2 = \(\dfrac{m_{BaCl2}}{M_{BaCl2}}=\dfrac{20,8}{208}=0,1\left(mol\right)\)
Pt : BaCl2 + H2SO4 → BaSO4 + 2HCl\(|\)
1 1 1 2
0,1 0,1 0,1 0,2
a) Số mol của bari sunfat
nBaSO4 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,1. 233
= 23,3 (g)
b) Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
c) Số mol của axit clohidric
nHCl = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của axit clohidirc
mHCl = nHCl . MHCl
= 0,2 . 36,5
= 7,3 (g)
Khối lượng của dung dịch axit sunfuric
D = \(\dfrac{m}{V}\Rightarrow m=D.V=1,14.200=228\left(g\right)\)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mBaCl2 + mH2SO4 - mBaSO4
= 200 + 228 - 23,3
= 404,7 (g)
Nồng độ phần trăm của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,3.100}{404,7}=1,8\)0/0
Chúc bạn học tốt
BaCl2+ H2SO4→ BaSO4+ 2HCl
(mol) 0,1 0,1 0,2 a) \(m_{BaCl_2}=\)200.10,4%=20,8(g)
→\(n_{BaCl_2}=\dfrac{m}{M}=\dfrac{20,8}{208}=0,1\left(mol\right)\)
=>\(m_{BaSO_4}=n.M=\)0,1.233=23,3(g)
b) Đổi:200ml=0,2 lít
CM=\(\dfrac{n_{H_2SO_4}}{V_{dd}H_2SO_4}\)=\(\dfrac{0,1}{0,2}=0,5M\)
c)ta có: d=\(\dfrac{m}{V}\)=> \(m_{dd}H_2SO_4=d.V=\)1,14.200=228(g)
mdd sau phản ứng=\(m_{BaCl_2}+m_{dd}H_2SO_4\)=200+228=428(g)
mHCl=n.M=0,2.36,5=7,3(g)
=>C%dd HCl=\(\dfrac{m_{HCl}}{m_{dd}}.100\%=\dfrac{7,3}{428}.100\%=1,7\%\)
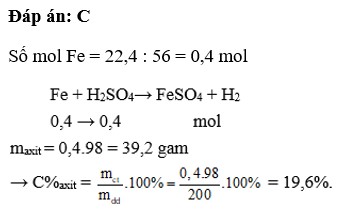
nFe= 22,4/56=0,4 mol
Fe+H2SO4→FeSO4+H2
0,4 0,4 mol
mctH2SO4=0,4.98=39,2 g
C%=39,2/200 .100%=19,6 %