cho 4 gam Ca cháy trong khí oxi thu được CaO. khối lượng của oxxi phản ứng là bao nhiu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Anh nghĩ nhôm oxit khối lượng 1,02 sẽ đúng hơn em ạ!

a) Viết công thức về khối lượng của phản ứng xảy ra.
b0 Tính khối lượng của khí oxi phản ứng.
Hướng dẫn giải:
a) Công thức về khối lượng của phản ứng
mMg + mO2 = mMgO
b) Khối lượng của khí oxi tham gia phản ứng:
mO2 = mMgO – mMg
=> mO2 = 15 – 9 = 6(g)
Ta có : Sau khi cân bằng phương trình trên được :
2Mg + O2 ===> 2MgO
Công thức về khối lượng của phản ứng trên là :
m2Mg + mO2 = m2MgO
Từ trên => 9 gam+ mO2 = 15 gam
=> mO2 = 6 gam
Vậy khối lượng Oxi đã phản ứng là 6 gam

\(1,PTHH:2Mg+O_2\xrightarrow{t^o}2MgO\\ 2,m_{Mg}+m_{O_2}=m_{MgO}\\ 3,m_{O_2}=15-9=6(g)\)

Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)

a)
\(n_{P_2O_5} = \dfrac{42,6}{142} = 0,3(mol)\\ \)
4P + 5O2 \(\xrightarrow{t^o}\) 2P2O5
0,6.............0,75.................0,3..........(mol)
mP = 0,6.31 = 18,6(gam)
b)
2KClO3 \(\xrightarrow{t^o}\) 2KCl + 3O2
0,5....................................0,75.....(mol)
\(m_{KClO_3} = 0,5.122,5 = 61,25(gam)\)
c)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
\(n_{Fe} = \dfrac{16,8}{56} = 0,3(mol)\\ \dfrac{n_{Fe}}{3} = 0,1 < \dfrac{n_{O_2}}{2} = 0,375\)
nên hiệu suất tính theo số mol Fe.
\(n_{Fe\ pư} = 0,3.90\% = 0,27(mol)\\ n_{Fe_3O_4} =\dfrac{1}{3}n_{Fe\ pư} = 0,09(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,09.232 = 20,88(gam)\)

Cảm ơn bạn @anayuiky đã nhắc lỗi sai. Mình sửa lại ý c):
PTHH: \(2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Theo phương trình \(n_{KMnO_4}=n_{O_2}.2=0,25.2=0,5mol\)
\(\rightarrow m_{KMnO_4}=0,5.\left(39+55+16.4\right)=79g\)
a. \(n_{H_2}=\frac{V}{22,4}=\frac{11,2}{22,4}=0,5mol\)
\(n_{O_2}=\frac{V}{22,4}=\frac{10,08}{22,4}=0,45mol\)
PTHH: \(2H_2+O_2\rightarrow^{t^o}2H_2O\)
Ban đầu: 0,5 0,45 mol
Trong pứng: 0,5 0,25 0,5 mol
Sau pứng: 0 0,2 0,5 mol
\(\rightarrow M_{O_2\left(dư\right)}=n.M=0,2.32=6,4g\)
b. Theo phương trình \(n_{H_2O}=n_{H_2}=0,5mol\)
\(\rightarrow m_{H_2O}=n.M=0,5.18=9g\)
c. PTHH: \(2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,9 0,45 mol
\(\rightarrow n_{KMnO_4}=\frac{2}{1}n_{O_2}=\frac{0,45.2}{1}=0,9mol\)
\(\rightarrow m_{KMnO_4}=n.M=0,9.158=142,2g\)

Áp dụng định luật BTKL:
\(a,m_{Mg}+m_{O_2}=m_{MgO}\\ b,m_{O_2}=m_{MgO}-m_{Mg}=50-42=8\left(g\right)\)

4Al + 3O2 --to--> 2Al2O3
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
___________0,15<------0,1
=> mO2 = 0,15.32 = 4,8(g)
Bảo toàn KL: \(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
\(\Rightarrow m_{O_2}=10,2-9=1,2(g)\)
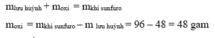
\(n_{Ca} = \dfrac{4}{40} = 0,1\ mol\\ 2Ca + O_2 \xrightarrow{t^o} 2CaO\\ n_{O_2} = \dfrac{n_{Ca}}{2} = \dfrac{0,1}{2} = 0,05\ mol\\ \Rightarrow m_{O_2} = 0,05.32 = 1,6\ gam\)