Công thức hóa học của sắt(III) oxit là
A. Fe2O3.
B. Fe(OH)3.
C. Fe2(SO4)3.
D. Fe3O4.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


* Gọi hóa trị của Fe trong công thức 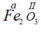 là a.
là a.
Theo quy tắc hóa trị ta có: a.2 = II.3 ⇒ a = III ⇒ Fe có hóa trị III
* Công thức dạng chung của Fe(III) và nhóm SO4 hóa trị (II) là 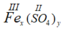
Theo quy tắc hóa trị ta có: III.x = II. y ⇒ 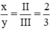 ⇒ chọn x = 2, y = 3
⇒ chọn x = 2, y = 3
⇒ Công thức hóa học là Fe2(SO4)3
Đáp án D

Đáp án D
Ngoại trừ: Fe(OH)3, Fe2O3, Fe(NO3)3 và Fe2(SO4)3

biểu diễn phản ứng hóa học trên là
A Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
B Fe(SO4)2 + NaOH → FeOH + Na(SO4)2
C Fe2(SO4)3 + NaOH → Fe2(OH) + Na(SO4)3
D FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow Fe\left(OH\right)_3+3Na_2SO_4\\ \Rightarrow A\)

Câu 70: Công thức hoá học của sắt oxit, biết Fe(III) là:
A. Fe2O3. B. FeO.
C. Fe3O4. D. Fe3O2.
Câu 71: Oxit khi tác dụng với nước tạo ra dung dịch axit sunfuric là:
A. CO2 B. SO2
C. SO3 D. K2O
Câu 72: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A. CO2 B. SO2
C. N2 D. O3
Câu 73: Khí có tỉ khối đối với hiđro bằng 32 là
A. N2O B. SO2
C. SO3 D. CO2
Câu 74: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg B. Zn, Fe, Cu
C. Zn, Fe, Al D. Fe, Zn, Ag
Câu 75: Khi cho giấy quỳ tím vào dung dịch NaOH thì hiện tượng quan sát được :
A. Màu tím chuyển sang màu đỏ B. Màu tím chuyển sang màu hồng
C. Màu tím chuyển sang màu xanh D. Không thay đổi màu
Câu 76: Khi cho giấy quỳ tím vào dung dịch NaCl thì hiện tượng quan sát được :
A. Màu tím chuyển sang màu đỏ B. Màu tím chuyển sang màu hồng
C. Màu tím chuyển sang màu xanh D. Không thay đổi màu
Câu 77: Có 3 bình riêng biệt đựng 3 dung dịch NaCl, Ba(NO3)2 và H2SO4. Thuốc thử tốt nhất có thể dùng để phân biệt dung dịch H2SO4 là:
A. Dung dịch NaOH. B. Dung dịch NaCl C. Dung dịch BaCl2. D. Dung dịch HCl
Câu 78: Phản ứng nào sau đây xảy ra chính xác nhất:
A. Cu + H2SO4 đặc nóng → CuSO4 + SO2 + H2O
B. Fe + H2SO4 đặc nóng → Fe2(SO4)3 + H2 + H2O
C. Fe + H2SO4 đặc nguội → Fe2(SO4)3 + SO2 + H2O
D. Fe + H2SO4 → Fe2(SO4)3 + H2
Câu 79: Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là:
A. Zn, ZnO, Zn(OH)2. | C. Na2O, NaOH, Na2CO3 |
B. Cu, CuO, Cu(OH)2. | D. MgO, MgCO3, Mg(OH)2. |
Câu 80: Cho phản ứng sau: Na + S →t0 sản phẩm sau phản ứng là:
A. Na2S B. NaS
C. Na3S D. Cả A, B và C
Câu 81: Cho phản ứng sau: F2 + S →t0 sản phẩm sau phản ứng là:
A. S2F6 B. S2F
C. SF6 D. Cả A, B và C
Câu 82: Cho phản ứng sau: Mg + S →t0 sản phẩm sau phản ứng là:
A. Mg2S B. MgS
C. Mg3S D. Cả A, B và C
Câu 83: Ở điều kiện bình thường Axit Sunfuric (H2SO4) tồn tại ở trạng thái :
A. Rắn B. Lỏng
C. Khí D. Cả A, B và C
Câu 84: Lưu huỳnh đioxit (SO2) ở điều kiện bình thường tồn tại ở trạng thái:
A. Rắn B. Lỏng
C. Khí D. Cả A, B và C
Câu 85: Ở điều kiện bình thường lưu huỳnh đioxit (SO2) so với không khí:
A. Nặng hơn B. Nhẹ hơn
C. Lơ lửng D. Cả A, B và C
Câu 86: Ở điều kiện bình thường Oxi (O2) tồn tại ở trạng thái :
A. Rắn B. Lỏng
C. Khí D. Cả A, B và C
Câu 87: Ở điều kiện bình thường Lưu huỳnh (S) tồn tại ở trạng thái :
A. Rắn B. Lỏng
C. Khí D. Cả A, B và C
Câu 88: Cho phản ứng sau: NaOH + H2SO4 → sản phẩm sau phản ứng là:
A. Na3SO4 + H2O B. Na2SO4 + H2
C. Na2SO4 + H2O D. Cả A, B và C
Câu 89: Ở điều kiện bình thường Ozon (O3) tồn tại ở trạng thái :
A. Rắn B. Cu
C. Khí D. Zn
Câu 90: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại:
A. Mg B. Nhẹ hơn
C. Ba D. Cả A, B và C
Câu 91: Cho phản ứng sau: Na2O + H2SO4 → sản phẩm sau phản ứng là:
A. Na3SO4 + H2O B. Na2SO4 + H2
C. Na2SO4 + H2O D. Cả A, B và C
Câu 92: Ở điều kiện bình thường Oxi (O2) là chất khí :
A. Có mùi B. Không mùi
C. Không vị D. Cả B và C
Câu 93: Sản phẩm của phản ứng khi sục khí SO2 vào dd Brom là:
A. H2SO3 , HBrO B. H2S, HBr C. H2SO4 , HBr D. S, HBr.
Câu 94: Chất xúc tác là chất:
A. Làm giảm tốc độ phản ứng. B. Làm tăng tốc độ phản ứng .
C. Chất tham gia vào phản ứng tạo sản phẩm. C. Chất tạo màu cho phản ứng
Câu 95: Nhỏ dd AgNO3 vào dd HI , hiện tượng quan sát được là:
A. Kết tủa trắng. B. Khí thoát ra. C. Kết tủa vàng. D. Màu xanh xuất hiện
Câu 96: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2. | B. SO3. |
C. SO2. | D. H2S. |
Câu 97: Cho phản ứng: SO2 + Cl2 + 2H2O → 2HCl + H2SO4. Vai trò của clo trong phản ứng là:
A. Chất oxi hóa | B. Chất khí |
C. Chất oxi hóa và chất khử | D. Tất cả đều sai |
Câu 98: Điều chế O2 trong công nghiệp bằng cách
A. Điện phân nước | B. Chưng cất phân đoạn không khí hóa lỏng |
C. Nhiệt phân KMnO4 | D. Cả A và B |
Câu 99: Cho BaCl2 phản ứng với dung dịch H2SO4, sản phẩm sau phản ứng là:
A. BaSO4 + H2O | B. BaSO4 + H2 |
C. BaSO4 + HCl | D. Không có phản ứng |
Câu 100: Một hỗn hợp gồm 3 kim loại Cu, Al và Fe cho tác dụng vừa đủ với 1 lít dung dịch HCl loãng dư, thu được 5,6 lít khí X ( đktc ) và 6,4 gam chất rắn Y. Nếu cũng cho lượng hỗn hợp trên tác dụng với dịch H2SO4 đặc, nguội, thì sau phản ứng thu được 8,3gam chất rắn Z. Vậy X, Y, Z là:
A. SO2, Fe, Cu | B. H2, Fe, Cu |
C. SO2, Cu, Fe | D. H2, Cu, Fe |

a) \(Ba\rightarrow Ba\left(OH\right)_2\rightarrow BaCl_2\rightarrow Ba\left(NO_3\right)_2\rightarrow BaCO_3\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
\(BaCl_2+2AgNO_3\rightarrow Ba\left(NO_3\right)_2+2AgCl\downarrow\)
\(Ba\left(NO_3\right)_2+K_2CO_3\rightarrow2KNO_3+BaCO_3\downarrow\)
b) \(Fe\rightarrow Fe_3O_4\rightarrow Fe_2O_3\rightarrow Fe_2\left(SO_4\right)_3\rightarrow FeCl_3\rightarrow Fe\left(OH\right)_3\rightarrow Fe\left(NO_3\right)_3\)
\(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(2Fe_3O_4+\dfrac{1}{2}O_2\xrightarrow[]{t^o}3Fe_2O_3\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(Fe_2\left(SO_4\right)_3+3BaCl_2\rightarrow2FeCl_3+3BaSO_4\downarrow\)
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3\downarrow+3KCl\)
\(Fe\left(OH\right)_3+3HNO_3\rightarrow Fe\left(NO_3\right)_3+3H_2O\)

a, \(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_{3\downarrow}\)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, (1) \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeCl_2+Zn\rightarrow ZnCl_2+Fe\)
\(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\)
\(FeSO_4+2NaOH\rightarrow Na_2SO_4+Fe\left(OH\right)_{2\downarrow}\)
\(Fe\left(OH\right)_2\xrightarrow[khongcokhongkhi]{t^o}FeO+H_2O\)
\(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
(2) \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
c, \(2FeS_2+\dfrac{11}{2}O_2\underrightarrow{t^o}Fe_2O_3+4SO_2\)
\(2SO_2+O_2⇌2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
\(Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\)
\(2NaOH+ZnO\rightarrow Na_2ZnO_2+H_2O\)
Bạn tham khảo nhé!
Chọn A