Cho Fe phản ứng với dung dịch H 2 SO 4 thu được khí A và 11,04 gam muối. Tính khối lượng Fe phản ứng biết rằng số mol Fe phản ứng bằng 37,5% số mol H 2 SO 4 phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2 Fe + 2n H2SO4 --> Fe2(SO4)n + n SO2 + n H2O
a------------an-----------0,5a
số mol Fe bằng 37,5% => a = 0,375*na => n = 2,667 khối lượng muối = 0,5a(56+96n) = 8,28 => a = 0,045 khối lượng Fe = 56*0,045 = 2,52
=> Đáp án A

\(n_{NO} =\dfrac{6,72}{22,4} = 0,3(mol)\\ 4H^+ +NO_3^- \to NO + 2H_2O\\ n_{HNO_3\ pư} = 4n_{NO} = 0,3.4 = 1,2(mol)\\ \Rightarrow n_{Fe\ pư} = 1,2.32,5\% = 0,39(mol)\\ \Rightarrow m = 0,39.56 = 21,84\ gam\\ n_{Fe(NO_3)_2} = a\ mol\ ;\ n_{Fe(NO_3)_3} = b\ mol\\ \Rightarrow a + b = 0,39(1)\\ BT\ e\ :2a + 3b = 0,3.3(2)\\ (1)(2) \Rightarrow a = 0,27 ; b = 0,12\\ \Rightarrow m_{Fe(NO_3)_3} = 0,12.242 = 29,04\ gam\)
cho 8.96 g fe tan hết trong dd hno2 loãng thu được dd X chứa 34.38 g chất tan. tính kl fe(no3)3 trong đd X

Định hướng tư duy giải
Ta có:
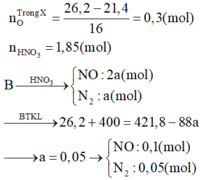

Chất tan trong bình gồm hỗn hợp muối và HNO3 dư.
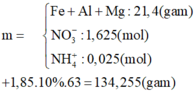

\(2Fe+6H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
Gọi 0,375a là mol Fe \(\Rightarrow\) nH2SO4= a mol
\(n_{Fe_{pu}}=\frac{a}{3}\left(mol\right)\)
Nên dư a/24 mol Fe. Tạo a/6 mol Fe2(SO4)3
\(Fe+Fe_2\left(SO_4\right)_3\rightarrow3FeSO_4\)
\(\Rightarrow\) nFeSO4= a/8 mol. Dư a/8 mol Fe2(SO4)3.
m muối= 8,28g
\(\Rightarrow\frac{152a}{8}+\frac{400a}{8}=8,28\)
\(\Rightarrow a=0,12\)
nFe phản ứng= 0,375a= 0,045 mol
\(\Rightarrow m_{Fe}=2,52\left(g\right)\)
\(n_{H2SO4}=0,12\left(mol\right)\Rightarrow n_{SO2}=0,06\left(mol\right)\)
\(n_{NaOH}=0,1\left(mol\right)\)
\(\frac{n_{NaOH}}{n_{SO2}}=1,67\Rightarrow\) Tạo 2 muối
\(NaOH+SO_2\rightarrow NaHSO_3\)
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
Gọi x là mol NaHSO3, y là mol Na2SO3
\(\left\{{}\begin{matrix}x+2y=0,1\\x+y=0,06\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,02\\y=0,04\end{matrix}\right.\)
\(CM_{NaHSO3}=\frac{0,02}{0,1}=0,2M\)
\(CM_{Na2SO3}=\frac{0,04}{0,1}=0,4M\)

Chọn đáp án B
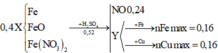
Y có thể gồm các ion thuộc 1 trong 3 trường hợp:
TH1: Fe2+ (có thể), Fe3+, H+, S O 4 2 -
TH2: Fe2+ (có thể), N O 3 - , S O 4 2 -
TH3: Fe3+, H+, N O 3 - , S O 4 2 -
Lượng Cu và Fe hoà tan tối đa là như nhau Þ Chỉ có thể là TH2 hoặc TH3 vì TH1 có H+ mà không
có N O 3 - Þ Tạo thêm H2, làm cho lượng Fe tối đa hoà tan được nhiều hơn Cu
nCu max = nFe max = 0,16 Þ Số mol Fe3+ trong Y tối đa = 0,16x2 = 0,32
Với TH3 thì nFe3+ = 0,4 Þ Chỉ có TH2 thỏa mãn Y
Trong đó Y chứa: Fe3+ (0,32 mol), Fe2+ (0,08 mol), N O 3 - , S O 4 2 - (0,52 mol)
BTĐT Þ nNO = 0,32x3 + 0,08x2 - 0,52x2 = 0,08
Bán phản ứng Þ nFeO = (0,52x2 - 0,24x4)/2 = 0,04
BTNT.N Þ nFe(NO3)2 = (0,24 + 0,08)/2 = 0,16 Þ nFe = 0,4 - 0,16 - 0,04 = 0,2
Vậy %Fe(NO3)2 = ![]()

Chọn đáp án D
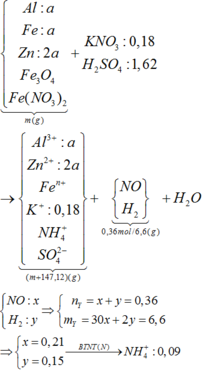
Y có thể hoà tan được Cu và Fe sinh ra NO ⇒ Còn dư H+ và N O 3 - trong Y
⇒ Dung dịch Y gồm: Fe3+, H+, N O 3 - và S O 2 -

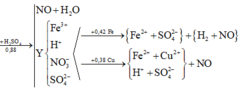
Y hoà tan tối đa 0,42 mol Fe nhưng chỉ hoà tan tối đa 0,38 mol Cu, sự chênh lệch này là do Cu không tác dụng với H+ tạo H2, đặt Z là dung dịch sau khi Y phản ứng với Cu


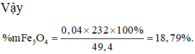
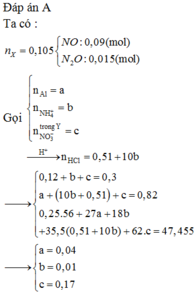


Axit H 2 SO 4 không biết là loãng hay đặc, khí thoát ra không biết là H 2 và SO 2 nên chưa kết luận được
Nếu H 2 SO 4 là loãng → phản ứng với Fe tỉ lệ 1 : 1 → loại V
Nếu H 2 SO 4 đặc nóng → phản ứng với Fe tỉ lệ 1 : 3 → có thêm phản ứng giữa Fe với muối Fe 3 + tạo ra muối Fe 2 +
Các phản ứng cho - nhận e xảy ra:
Fe → Fe 3 + + 3e (1)
Fe + 2 Fe 3 + → 3 Fe 2 + (2)
Nếu gọi số mol H 2 SO 4 phản ứng là x thì số mol Fe phản ứng ( 1 ) là x/3 số mol Fe phản ứng (2) là y, vậy ta có :
x/3 + y = 0,375x => 24y = x (*)
Mặt khác :
m muối = m FeSO 4 + m Fe 2 SO 4 3 = 152.3y + 400x
(x/3 -2y)/2 = 11,04 (**)
Thay (*) vào (**) giải được y = 0,0067; x = 0,16
Vậy khối lượng Fe phản ứng là: 0,16.0,375.56 = 3,36 (gam).