Đốt cháy hoàn toàn 22,2 gam một hỗn hợp gồm este có công thức CH 3 COO C n H 2 n + 1 và ancol C n H 2 n + 1 OH, thu được 44 gam khí CO 2 và 19,8 gam H 2 O . Hãy xác định công thức phân tử của este và ancol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B

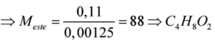
Như vậy, công thức axit và ancol có thể là CH3COOH và C2H5OH

Chọn đáp án B
Đặt nNaOH = x. Bảo toàn nguyên tố Natri: nNa2CO3 = 0,5x || Bảo toàn khối lượng:
mP = (4,78 + 53x) (g). A gồm các ancol no, đơn chức, mạch hở ⇒ có dạng: CnH2n+2O.
► Để ý: CnH2n+2O = (CH2)n.H2O ||⇒ Quy A về CH2 và H2O ⇒ nH2O = x mol.
● Mặt khác: nCO2 = nO2 ÷ 1,5 = 0,23 mol ⇒ mA = mCH2 + mH2O = (3,22 + 18x) (g).
Bảo toàn khối lượng: mN + mNaOH = mA + mP ||⇒ x = 0,18 mol ⇒ nN = 0,18 mol.
► Xét phản ứng đốt P: đặt nCO2 = a; nH2O = b ⇒ 44a + 18b = 14,06(g). Lại có:
nCOONa = 0,18 mol; nNa2CO3 = 0,09 mol. Bảo toàn nguyên tố Oxi:
0,18 × 2 + 0,29 × 2 = 0,09 × 3 + 2a + b ||⇒ giải hệ có: a = 0,25 mol; b = 0,17 mol.
● Bảo toàn nguyên tố Cacbon và Hidro: nCO2 đốt N = 0,57 mol; nH2O đốt N = 0,49 mol.
► Lại có: nCO2 – nH2O = ∑nπ – n. Áp dụng: ∑nπ = 0,57 - 0,49 + 0,18 = 0,26 mol.
π gồm πC=O và πC=C nhưng tác dụng với Br2/CCl4 chỉ có πC=C.
nπ C=O = nCOO = 0,18 mol ⇒ nBr2 = nπ C=C = 0,26 - 0,18 = 0,08 mol ⇒ chọn B.
► Chú ý: -CHO chỉ tác dụng với Br2/H2O
||⇒ không cần quan tâm nếu N chứa este của HCOOH.

Chọn đáp án B
Đặt nNaOH = x.
Bảo toàn nguyên tố Natri: nNa2CO3 = 0,5x
Bảo toàn khối lượng:
mP = (4,78 + 53x) (g).
A gồm các ancol no, đơn chức, mạch hở ⇒ có dạng: CnH2n+2O.
► Để ý: CnH2n+2O = (CH2)n.H2O
⇒ Quy A về CH2 và H2O ⇒ nH2O = x mol.
● Mặt khác:
nCO2 = nO2 ÷ 1,5 = 0,23 mol
⇒ mA = mCH2 + mH2O = (3,22 + 18x) (g).
Bảo toàn khối lượng: mN + mNaOH = mA + mP
⇒ x = 0,18 mol ⇒ nN = 0,18 mol.
► Xét phản ứng đốt P:
đặt nCO2 = a; nH2O = b
⇒ 44a + 18b = 14,06(g).
Lại có:
nCOONa = 0,18 mol; nNa2CO3 = 0,09 mol.
Bảo toàn nguyên tố Oxi:
0,18 × 2 + 0,29 × 2 = 0,09 × 3 + 2a + b
⇒ giải hệ có: a = 0,25 mol; b = 0,17 mol.
● Bảo toàn nguyên tố Cacbon và Hidro:
nCO2 đốt N = 0,57 mol; nH2O đốt N = 0,49 mol.
► Lại có: nCO2 – nH2O = ∑nπ – n.
Áp dụng:
∑nπ = 0,57 - 0,49 + 0,18 = 0,26 mol.
π gồm πC=O và πC=C nhưng tác dụng với Br2/CCl4 chỉ có πC=C.
nπ C=O = nCOO = 0,18 mol
⇒ nBr2 = nπ C=C = 0,26 - 0,18 = 0,08 mol

Đáp án B
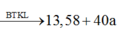
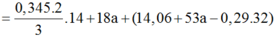
![]()
Khi N cháy 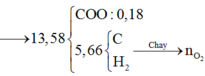
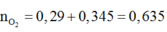
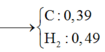
![]()
![]()
Chú ý: HCOO- không tác dụng với Br2 trong CCl4, nhưng tác dụng đưuọc với Br2 trong nước (dung dịch nước Br2).

Chọn đáp án B
Hỗn hợp Y gồm ancol dạng CnH2n + 2O và este dạng CmH2mO2 (n ≥ 1; m ≥ 2).
• đốt Y + 0 , 19 m o l O 2 → t 0 0 , 14 m o l C O 2 + 0 , 17 m o l H 2 O
♦ Tương quan đốt: n a n c o l = ∑ n H 2 O – ∑ n C O 2 = 0 , 17 – 0 , 14 = 0 , 03 m o l
bảo toàn nguyên tố O có ∑ n O t r o n g Y = 0 , 07 m o l ⇒ n e s t e = ( 0 , 07 – 0 , 03 ) ÷ 2 = 0 , 02 m o l
⇒ xây dựng pt nghiệm nguyên:
0,03n + 0,02m = 0,14
⇔ 3n + 2m = 14
Nghiệm duy nhất thỏa mãn là n = 2; m = 4 ứng với ancol là C2H5OH.

Chọn đáp án B
+ Đốt este no đơn chức mạch hở ⇒ n H 2 O = n C O 2 = 0 , 1 m o l
+ Thủy phân este trong môi trường axit
⇒ Chỉ thêm vào hỗn hợp H2O.
⇒ Không ảnh hưởng đến nguyên tố cacbon ⇒ n C O 2 k h ô n g đ ổ i
⇒ V C O 2 = 0 , 1 × 22 , 4 = 2 , 24 l í t
⇒ Đốt 1 2 hỗn hợp Y ⇒ V C O 2 = 1 , 12 l í t
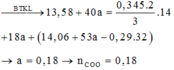
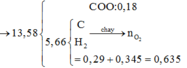
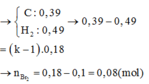


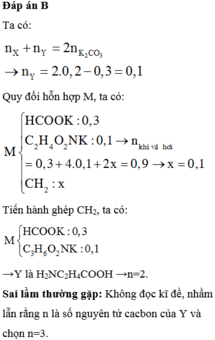
Phương trình hóa học :
CH 3 COO C n H 2 n + 2 + (3n+4)/2 O 2 → (n+2)C O 2 + (n+2) H 2 O
C n H 2 n + 2 OH + 3n/2 O 2 → nC O 2 + (n+1) H 2 O
Áp dụng định luật bảo toàn khối lượng :
=> 22,2 + m O 2 = 44 + 19,8 => m O 2 = 41,6g
Sau phản ứng: m O = 44/44 x 32 + 19,8/18 x 16 = 49,6g
Vậy khối lượng oxi có trong este và ancol là : 49,6 - 41,6 = 8 (gam).
Theo phương trình hoá học khi đốt cháy este thu được n CO 2 = n H 2 O còn khi đốt cháy ancol số mol H 2 O lớn hơn số mol C O 2 .
=> n ancol = n H 2 O - n CO 2 = 1,1 - 1 = 0,1 mol
Vậy khối lượng oxi trong este là : 8 - 16.0,1 = 6,4g
=> n este = 6,4/32 = 0,2 mol
=> 0,2(n+2) + 0,1n = 1
=> 2n + 4 + n = 10 => n = 2