Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bạn xem ở link này nè có lời giải khá chi tiết đấy: http://hoctap.dvtienich.com/questions/question/nung-2528-gam-hon-hop-feco3-va-fexoy-trong-oxi-du-toi-phan-ung-hoan-toan/

Ptpư CnH2n+2 + Cl2 CnH2n+1Cl + HCl
CnH2n+2 + 2Cl2 CnH2nCl2 + 2HCl
HCl + NaOH → NaCl + H2O
Số mol NaOH = mol HCl = mol Cl2 = 0,3 mol
Theo ĐLBTKL: mankan = 15,75 + 36,5.0,3 – 71,0,3 = 5,4 gam
→ 0,15 < molankan < 0,3
→ 5,4/0,3 < Mankan < 5,4/0,15
→ 18 < 14n + 2 < 36
→ 1,14 < n < 2,43 → n = 2 → CTPT ankan: C2H6
hình như là ankan thì phải mik k rỏ về bài này lắm

\(2A+nCI2\rightarrow2ACIn\)
\(nA=\frac{1.96}{M}\)
\(nACI2=\frac{5,6875}{\left(M+35,5n\right)}\)
\(nA=nACI2\)
\(\Rightarrow\frac{1,96}{M}=\frac{5,6875}{\left(M+35,5n\right)}\)
\(\Rightarrow M=\frac{56}{3n}\)
\(\Rightarrow n=1\) \(M=\frac{56}{3}\left(Loại\right)\)
\(n=2\) \(M=\frac{112}{3}\left(Loại\right)\)
\(n=3\) \(M=56\)
Vậy A là Fe
\(Fe+HCI\rightarrow FeCI2+H2\)
\(FexOy+\frac{HCI\rightarrow FeCI2y}{x+H2O}\)
\(FexOy+H2\rightarrow Fe+H2O\)
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
\(nFe=a\Rightarrow nHCI=2a\)
\(nFexOy=b\Rightarrow nHCI=2by\)
\(nHCI=0,08\cdot2=1,6mol\)
\(\Rightarrow2a+2by=0,16\)
\(\Rightarrow a+by=0,08\left(1\right)\)
\(56a+b\left(56x+16y\right)=4,6\Rightarrow56a+56bx+16by=4,6\left(2\right)\)
Chất rắn X là Fe
\(nFexOy=b\)
=> nFe sinh ra là bx
\(\Rightarrow56a+56bx=3,64\left(3\right)\)
Từ (1) (2) và (3) ta có hệ:
\(\begin{cases}a+by=0,08\\56a+56bx+16by=4,6\\56a+56bx=3,64\end{cases}\)
\(a=0,02\\
bx=0,045\\
by=0,06\)
\(\frac{\Rightarrow bx}{by}=\frac{x}{y}=\frac{0,045}{0,06}=\frac{3}{4}\)
=> Công thức của oxit cần tìm là: Fe3O4
2A+nCl2 -------------->2ACln
nA=1.96/M
nACl2=5,6875/(M+35,5n)
nA=nACl2
=> 1,96/M=5,6875/(M+35,5n)
=>M=56/3n
=> n=1 M=56/3 (Loại)
n=2 M=112/3 (Loại)
n=3 M=56
Vậy A là Fe
Fe+HCl--->FeCl2+H2
FexOy+HCl---->FeCl2y/x+H2O
FexOy+H2---->Fe+H2O
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
nFe=a=>nHCl=2a
nFexOy=b=>nHcl=2by
nHCl=0,08*2=1,6 mol
=> 2a+2by=0,16
=> a+by=0,08 (1)
56a+b(56x+16y)=4,6=> 56a+56bx+16by=4,6 (2)
Chất rắn X là Fe
nFexOy=b
=> nFe sinh ra là bx
=> 56a+56bx=3,64 (3)
Từ (1) (2) và (3) ta có hệ:
{a+by=0,08
{56a+56bx+16by=4,6
{56a+56bx=3,64
a=0,02
bx=0,045
by=0,06
=> bx/by=x/y=0,045/0,06=3/4
=> Công thức của oxit cần tìm là: Fe3O4

Gọi số mol axit là a(mol)
số mol ancol là b(mol)
nCO2=0,6(mol)
=>a*(n+1)+bm=0,6(1)
nH2O=0,8(mol)
=>a*(n+1)+b*(m+1)=0,8(2)
mhh=15,2(g)
=>a*(14n+46)+b*(14m+18)=15,2(3)
từ(1,2,3)
=>a=0,1
b=0,2
na+mb=0,5
=>n+2m=5
ta có n+1\(\ne\)m
=> nghiệm đúng là n=3, m=1
Vậy x=0,1*102*0,9=9,18(g)

nCO2 = 2,688/22,4 = 0,12 mol; nH2O = 2,52/18 = 0,14 mol
Ta thấy nH2O>nCO2 => ancol là ancol no, đơn chức, mạch hở
Gọi công thức chung của ancol là CkH2k+2O (k €N*)
Giả sử:
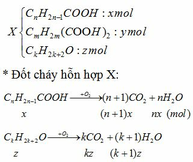
=> nH2O – nCO2 = nx – (n+1)x + (m+1)y – (m+2)y + (k+1)z – kz
=> 0,14 – 0,12 = -x - y + z hay -x - y + z = 0,02 (1)
BTNT ta tính được số mol của các nguyên tố:
nC = nCO2 = 0,12 mol
nH = 2nH2O = 2.0,14 = 0,28 mol
nO = 2nCnH2n-1COOH + 4nCmH2m(COOH)2 + nCkH2k+2O = 2x + 4y + z
=> mX = mC + mH + mO = 0,12.12 + 0,28.1 + 16(2x + 4y + z) = 32x + 64y + 16z + 1,72
* Phản ứng este hóa: Do sau phản ứng chỉ thu được chất có chứa chức este nên axit và ancol phản ứng vừa đủ
n ancol = x + 2y = z hay x + 2y – z = 0 (2)
BTKL ta có: mX = m este + mH2O => 32x + 64y + 16z + 1,72 = 3,22 + 18(x+2y)
hay 14x + 28y + 16z = 1,5 (3)
Từ (1) (2) (3) ta có hệ phương trình:
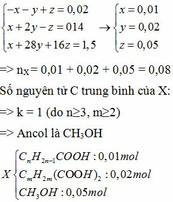
Bảo toàn nguyên tố C ta có: 0,01n + 0,02m + 0,05.1 = 0,12
=> n +2m = 7 mà do n≥3, m≥2 nên chỉ có cặp n = 3, m = 2 thỏa mãn
Vậy các axit trong X là: CH2=CH-COOH và HOOC-COOH.
Kết luận: Hỗn hợp X gồm các chất CH2=CH-COOH, HOOC-COOH và CH3OH.
- Một số ứng dụng của PVC trong thực tế như làm ống dẫn nước, vỏ dây điện, đồ giả da, áo mưa, nhãn chai nước khoáng, …

Gọi số mol trong mỗi phần: Fe = x mol; M = y mol.
Phần 1:
Fe + 2HCl FeCl2 + H2
(mol): x x
2M + 2nHCl 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
(mol): x 1,5x
2M + 2nH2SO4 (đặc) M2(SO4)n + nSO2 + 2nH2O
(mol): y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09. Vậy x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78 nên My = 0,54. Vậy hay M = 9n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 9 ( loại ) | 18 ( loại ) | 27 ( nhận ) |
Vậy M là \(Al\) ( nhôm ) .
Đặt a là số mol Fe, b là số mol của M,trong mỗi phần,n là hóa trị của M
PTHH: Fe +2HCl ---> FeCl2 + H2
a a
2M + 2n HCl ---> 2 MCln + n H2
b bn/2
n H2= 0.07
---> a + bn/2 = 0.07 (1)
m hh A = 56a + Mb = 2.78 (2)
PTHH: Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O
a a
3M +4n HNO3 ---->3M(NO3)n +nNO + 2n H2O
b bn/3
n NO = a + bn/3 = 0.06 (3)
Từ (1) và (3) giải hệ ta dc : a= 0.04
bn = 0.06---> b= 0.06/n (4)
Thế à= 0.04vào pt (2) giải ra ta đc : 2.24 + Mb = 2.78
-----> b = 0.54/ M (5)
Từ (4) và (5) ----> M= 9n
Biện luận n
n=1 ----> M = 9 (loại)
n=2 ----> M= 18 (loại)
n=3-----> M=27 (nhận)
Do đó : M là Al

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam
Phương trình hóa học :
CH 3 COO C n H 2 n + 2 + (3n+4)/2 O 2 → (n+2)C O 2 + (n+2) H 2 O
C n H 2 n + 2 OH + 3n/2 O 2 → nC O 2 + (n+1) H 2 O
Áp dụng định luật bảo toàn khối lượng :
=> 22,2 + m O 2 = 44 + 19,8 => m O 2 = 41,6g
Sau phản ứng: m O = 44/44 x 32 + 19,8/18 x 16 = 49,6g
Vậy khối lượng oxi có trong este và ancol là : 49,6 - 41,6 = 8 (gam).
Theo phương trình hoá học khi đốt cháy este thu được n CO 2 = n H 2 O còn khi đốt cháy ancol số mol H 2 O lớn hơn số mol C O 2 .
=> n ancol = n H 2 O - n CO 2 = 1,1 - 1 = 0,1 mol
Vậy khối lượng oxi trong este là : 8 - 16.0,1 = 6,4g
=> n este = 6,4/32 = 0,2 mol
=> 0,2(n+2) + 0,1n = 1
=> 2n + 4 + n = 10 => n = 2