Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0
B. 18,0
C. 16,8
D. 11
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
0,725m gam hỗn hợp kim loại ||→ rõ có mỗi 2 kim loại là Fe và Cu rồi.
Phản ứng hoàn toàn, Fe còn dư → chứng tỏ trong dung dịch chỉ có Fe2+.
Oh.! đọc ra luôn từ anion là 0,15 mol FeSO4 và 0,1 mol FeCl2.
♦ BTKL kim loại có ngay: m + 0,15 × 64 = (0,15 + 0,1) × 56 + 0,725m
||→ giải ra m = 16,0 gam. Chọn đáp án C.

Đáp án A
Dung dịch sau phản ứng chứa FeSO4: 0,15 và FeCl2: 0,1 → m - 0,25.56 + 0,15.64 = 0,725m → m = 16

0,725m gam hỗn hợp kim loại
→ rõ có mỗi 2 kim loại là Fe và Cu rồi.
Phản ứng hoàn toàn, Fe còn dư → chứng tỏ trong dung dịch chỉ có Fe2+.
Oh.! đọc ra luôn từ anion là 0,15 mol FeSO4 và 0,1 mol FeCl2.
♦ BTKL kim loại có ngay: m + 0,15 × 64 = (0,15 + 0,1) × 56 + 0,725m
→ giải ra m = 16,0 gam
Đáp án C

Đáp án A
Dung dịch sau phản ứng chứa FeSO4: 0,15 và FeCl2: 0,1 → m - 0,25.56 + 0,15.64 = 0,725m → m = 16

Đáp án A
Dung dịch sau phản ứng chứa FeSO4: 0,15 và FeCl2: 0,1 → m - 0,25.56 + 0,15.64 = 0,725m → m = 16

Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g

Kim loại không tan là Cu dư.
Cu dư => Muối thu được gồm FeCl2 và CuCl2 vì: Cu + 2FeCl3 → CuCl2 + 2FeCl2
Số mol các chất là: 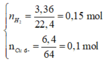
Sơ đồ phản ứng:
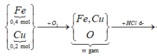
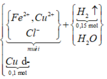
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án A.
Đáp án A
Fe + 2H+ → Fe2++ H2
Fe + Cu2+ → Fe2++ Cu
Bảo toàn khối lượng: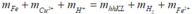
m + 64.0,15 + 0,2 = 0,725m + 2.0,1 + 56.0,25
⇒ m = 16g