Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Câu 1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x________x__(mol)
\(Al+2HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
y_____2y______y______3/2y__(mol)
\(n_{khí}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+\frac{3}{2}y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\frac{10,2-\left(24.0,2\right)}{0,2}.100\%=52,94\%\)
\(\%m_{Al}=100\%-52,94\%=47,06\%\)
\(m_{muoi}=95.0,2+133,5.0,2=28,6\left(g\right)\)
\(V_{HCl}=1,6\left(l\right)\)
Dùng 7,5% \(\Rightarrow V=1,6-1,6.7,5\%=1,48\left(l\right)\)
Câu 2:
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(n_{FeCl2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{AgCl}=2n_{FeCl2}=2.0,2=0,4\left(mol\right)\)
\(m_{AgCl}=0,4.143,5=57,4\left(g\right)\)
\(n_{Fe\left(NO3\right)2}=n_{FeCl2}=0,2\left(mol\right)\)
V dd sau phản ứng= VFeCl2 + VAgNO3 = 0,2+0,3= 0,5 (l)
\(\Rightarrow CM_{FeCl2}=\frac{0,2}{0,5}=0,4M\)

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

Chọn A
\(\hept{\begin{cases}\text{Mg, Al, Zn : x mol}\\\text{Fe : y mol}\end{cases}}\)\(\Rightarrow\)\(\hept{\begin{cases}\text{nx + 2y = 0,05.2}\\\text{nx + 2y = 2.}\left(\frac{\text{5,763 - 2}}{71}\right)\end{cases}}\)
\(\Rightarrow\)y = 0,006\(\Rightarrow\) %m\(_{Fe}\) = 16,8 %

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

Đáp án A
Fe + 2H+ → Fe2++ H2
Fe + Cu2+ → Fe2++ Cu
Bảo toàn khối lượng: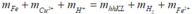
m + 64.0,15 + 0,2 = 0,725m + 2.0,1 + 56.0,25
⇒ m = 16g