Cho 16,25 gam kẽm vào 300 gam dung dịch HCl lấy dư, phản ứng hoàn toàn thu được dung dịch A và khí H 2 . Khối lượng dung dịch A là
A. 316,25 gam
B. 300,00 gam
C. 312,35 gam
D. 315,75 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Ta thấy chất rắn D gồm toàn oxit của Mg (và có thể của Fe) có m < mA
=> chứng tỏ A không phản ứng hết mà có kim loại dư.
Giả sử Fe chỉ phản ứng 1 phần với số mol là x; nMg = y
=> CuSO4 hết
=> moxit = mMgO + m F e 2 O 3 = 40y + 80x = 0,9g
Lại có : mB – mA = mCu – mMg – mFe pứ
=> 1,38 – 1,02 = 64.(x + y) – 24y – 56x
=> x = y = 0,0075 mol
=> n C u S O 4 = x + y = 0,015 mol
=> C M C u S O 4 = 0,075M

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
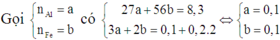
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO
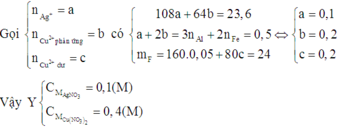

Đáp án A
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+. Do AgNO3 dư nên đặt


mFe= 8,4/56= 0,15 mol
m HCl = 14,6/36,5=0,4 mol
PTHH: Fe +2HCl →FeCl2 +H2
Bđ: 0,15 0,4 0 0 mol
Pứ: o,15→0,3 0,15 0,15 mol
Sau pứ:0 0,1 0,15 0,15 mol
a. HCl dư: m =0,1.36,5=3,65 g
b. m FeCl2 = 0,15.127=19,05 g
c. m H2 = 0,15.2= 0,3 g
V H2= 0,15.22,4=3,36 (l)

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

Đáp án B
nFeCl2 = nH2 = 0,1mol; nKMnO4 = 0,025 mol
Fe2+ sẽ phản ứng trước với KMnO4 / H+, mà thu được khí clo nên Fe2+ đã phản ứng hết, tiếp là Cl-
Bảo toàn e: nFe2+ + nCl- (pư) = 5.nMn+7
⇒ nCl- (pư) = 0,025 .5 – 0,1 = 0,025
nFe2+ + nCl- (pư) = 5.nMn7+ ⇒ nCl- (pư) = 0,025 .5 – 0,1 = 0,025 mol
⇒ nCl2 = 0,0125 mol ⇒ VCl2 = 0,28l
Chọn D
m d d s a u p ư = m c h ấ t t h a m g i a p ư – m H 2 → m d d s a u p ư = m Z n + m H C l – m H 2 = 16 , 25 + 300 – 0 , 25 . 2 = 315 , 75 g a m .