Trong dãy hợp chất của sắt FeO, Fe 2 O 3 , Fe 3 O 4 , Fe x O y , FeS, Fe S 2 oxi hoá của sắt lần lượt là
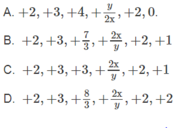
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\%M_{Fe}=\dfrac{M_{Fe}}{M_{hh}}.100\%\)
\(Fe_2(SO_4)_3, FeSO_4, FeS_2, FeS, Fe_2O_3, Fe_3O_4, FeO\)

Hợp chất trong đó sắt chiếm 70% khối lượng là hợp chất nào trong số các hợp chất sau ?
a) FeO b) Fe2O3 c) Fe3O4 d) Fe
Giải
%mO=30%
\(\frac{56x}{56x+72}\)
=>x=3
=>Fe2O3

a, Gọi x là hóa trị của P.
Ta có: 2x = 2.5
=> x = 5.
Vậy hóa trị của P trong hợp chất này là hóa trị V.
b, SO3
Gọi x là hóa trị của S.
Ta có: x = 2.3
=> x = 6.
Vậy hóa trị của S trong hợp chất này là hóa trị VI.
FeS2
Gọi x là hóa trị của S.
Ta có: 2x = 2.1
=> x = 1.
Vậy hóa trị của S trong hợp chất này là hóa trị I.
c, FeCl3
Gọi x là hóa trị của Fe.
Ta có: x = 3.1
=> x = 3.
Vậy hóa trị của Fe trong hợp chất này là hóa trị III.
FeCl2
Gọi x là hóa trị của Fe.
Ta có: x = 2.1
=> x = 2.
Vậy hóa trị của Fe trong hợp chất này là hóa trị II.
FeO
Gọi x là hóa trị của Fe.
Ta có: x = 2.1
=> x = 2.
Vậy hóa trị của Fe trong hợp chất này là hóa trị II.
Fe2O3
Gọi x là hóa trị của Fe.
Ta có: 2x = 3.2
=> x = 3.
Vậy hóa trị của Fe trong hợp chất này là hóa trị III.
Fe(OH)3
Gọi x là hóa trị của Fe.
Ta có: x = 3.1
=> x = 3.
Vậy hóa trị của Fe trong hợp chất này là hóa trị III.
FeSO4
Gọi x là hóa trị của Fe.
Ta có: x = 2.1
=> x = 2.
Vậy hóa trị của Fe trong hợp chất này là hóa trị II.
Fe2(SO4)3
Gọi x là hóa trị của Fe.
Ta có: 2x = 3.2
=> x = 3.
Vậy hóa trị của Fe trong hợp chất này là hóa trị III.
a/ P có hóa trị V
b/ SO3 => S : VI
FeS2 => S : I
c/ FeCl3 => Fe: III
FeCl2 => Fe: II
FeO => Fe: II
Fe2O3 => Fe: III
Fe(OH)3 ==> Fe: III
FeSO4 => Fe: II
Fe2(SO4)3 => Fe : III

1.Gọi CTC: FexSyOz
Theo đề : x = 2; 2*56/(2*56+32y+16z)=0,28
=> Mh/c= 400
=> y= 400. 24%/32=3
=> z=400.48%/16= 12
=> Fe2(SO4)3
2.
FeO : %mO = 16/(56+16)= 2/9
Fe2O3 : %mO= 16*3/(56*2+16*3)=3/10
Fe3O4: %mO=16*4/(56*3+16*4)=8/29
1. Gọi công thức hóa học của hợp chất là : FExSyOz. Theo đề bài ra ta có :
Khối lượng của Fe có trong hợp chất là : 56 . 2 = 112 (g)
Khối lượng của hợp chất đó là :\(\frac{112.100\%}{28\%}=400\)(g)
Khối lượng của nguyên tử S có trong hợp chất là :\(\frac{400.24\%}{100\%}=96\)(g)
Số nguyên tử S có trong hợp chất là : 96 :32 = 3 (nguyên tử)
Số nguyên tử O có trong hợp chất là : (400 - 112 - 96) : 16 = 12 (nguyên tử)
=> Công thức hóa học của hợp chất là : Fe2(SO4)3


2) \(\%m_{\dfrac{O}{FeO}}=\dfrac{16}{72}.100\approx22,222\%\\ \%m_{\dfrac{O}{Fe2O3}}=\dfrac{3.16}{160}.100=30\%\\ \%m_{\dfrac{O}{Fe3O4}}=\dfrac{64}{232}.100\approx27,586\%\)
Bài 1:
%mO=48%
M(phân tử)= (2.56)/28%=400(g/mol)
Số nguyên tử S: (24% . 400)/32= 3(nguyên tử)
Số nguyên tử O: (48% . 400)/16= 12(nguyên tử)
=> CTHH: Fe2(SO4)3

1. CO3 = 12+ 16.3 = 60g
kim loại đó mkl = 40% = 40g = Ca
PO4 = 31 + 16.4 = 95
% Ca = 40/(95+40).100% = 29,6%
2. % Fe trong fe0 = 56/(56+16) = 77,41%
vay nó là FeO

Quy đổi hỗn hợp 19.20g gồm Fe, FeO, Fe3O4 vào Fe2O3 dư.thành Fe và O bạn lập hệ giữa khối lượng và bảo toàn e với No2 tính đc nFe , vì Hỗn hợp A gồm Fe2O3,Fe3O4, FeO với số mol như nhau nên bạn gọi a là mol mỗi oxit và bảo toàn nguyên tố với nFe mk vừa tính đc xong tính đc x bảo toàn khối lượng --> y . nCo=nCo2=y/197
Chúc bạn học tốt!

Fe + O2 dư ----> Fe2O3 có nhiệt độ xúc tác
còn trường hợp Fe+O2 --> FeO là trường hợp Fe dư và khi nhiệt độ trên 450 độ C.

Trích các mẫu thử
Cho dd HCl vào các mẫu thử nhận ra:
+Ở hh thứ 2 thì dd ko màu;thoát khí
+Ở hh thứ 1 có màu nâu đỏ có thoát khí
+Ở hh thư 3 có màu nâu đỏ ko thoát khí
Fe + 2HCl -> FeCl2 + H2
FeO + 2HCl -> FeCl2 + H2O
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
Cho các hỗn hợp vào dd HCl dư nhận ra :
-Fe,Fe2O3( có khí bay lên, dd màu nâu đỏ:FeCl3)
-Fe,FeO( có khí bay lên, dd ko màu)
-Fe2O3,FeO( ko có khí, dd màu đỏ: FeCl3)
PTHH: Fe + 2HCl -> FeCl2 + H2
FeO + 2HCl-> FeCl2 + H2O
Fe2O3 + 6HCl->2FeCl3 + 3H2O
Đáp án D