Cho 0,01 mol Fe vào 50 ml dung dịch A g N O 3 1M. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là:
A. 5,4 g
B. 2,16 g
C. 3,24 g
D. Giá trị khác
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAgNO3=0,05(mol)
nFe= 0,01(mol)
PTHH: Fe + 2 AgNO3 -> Fe(NO3)2 + 2 Ag
0,01_____0,02_______0,01___0,02(mol)
Fe(NO3)2 + AgNO3 -> Fe(NO3)3 + Ag
0,01_______0,01_______0,01____0,01(mol)
=> m(Ag)= 0,03.108= 3,24(g)
50ml = 0,05l
Số mol của dung dịch bạc nitrat
CMAgNO3 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,05=0,05\left(mol\right)\)
Pt : Fe + 2AgNO3 → Fe(NO3)2 + 2Ag\(|\)
1 2 1 2
0,01 0,05 0,02
Lập tỉ số so sánh : \(\dfrac{0,01}{1}< \dfrac{0,05}{2}\)
⇒ Fe phản ứng hết , AgNO3 dư
⇒ Tính toán dựa vào số mol của Fe
Số mol của bạc
nAg = \(\dfrac{0,01.2}{1}=0,02\left(mol\right)\)
Khối lượng của bạc
mAg = nAg . MAg
= 0,02 . 108
= 2,16 (g)
Chúc bạn học tốt

Đáp án : B
Fe + 3AgNO3 -> Fe(NO3)3 + 3Ag
=> nAg = 3nFe = 0,06 mol < nAgNO3
=> mAg = 6,48g

\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)

Đáp án : A
nHCl = 0,1 mol ; nH2 = 0,075 mol
=> nHCl < 2nH2
=> Kim loại còn phản ứng với H2O tạo bazo
Gọi số mol Na và K lần lượt là x và y mol
Bảo toàn e : nNa + nK = 2nH2 => x + y = 0,15 mol
Theo đề : mhh = 23x + 39y = 4,25g
=> x = 0,1 ; y = 0,05 mol
Bảo toàn điện tích : nNa+ + nK+ = nCl- + nOH-
=> nOH- = 0,05 mol
=> m = mNa + mK + mOH + mCl = 8,65g

Đáp án : D
Al + 3Ag+ -> Al3+ + 3Ag
Fe + 2Ag+ -> Fe2+ + 2Ag
Fe2+ + Ag+ -> Fe3+ + Ag
Chất rắn sau phản ứng gồm : ( 0,1.3 + 0,1.2 + 0,05) = 0,55 mol Ag
=> m = 59,4g

Đáp án B.
Các phương trình hóa học có thể xảy ra :
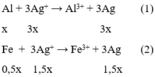
nAgNO3 = 0,3. 1 = 0,3 mol
Gọi số mol Al là x thì số mol Fe là 0,5x
Theo đề bài ta có: 27x + 56. 0,5x = 5,5 (1) suy ra x = 0,1 mol
Theo pt(1) nAgNO3 = 3. nAl = 3. 0,1 = 0,3 mol do đó chỉ xảy ra phản ứng (1).
Chất rắn thu được sau phản ứng là Ag và Fe
Khối lượng chất rắn = mAg + mFe = 0,3. 108 + 0,1. 0,5. 56 = 35,2 (g)
F e + 2 A g N O 3 → F e N O 3 2 + 2 A g
Ban đầu 0,01........1.0,05………mol
Phản ứng 0,01…0,02…..0,01……0,02……mol
Sau pứ 0..…0,03………0,01……0,02…mol
A g N O 3 + F e N O 3 2 → F e N O 3 3 + A g
Ban đầu 0,03………..0,01………mol
Phản ứng 0,01………...0,01……………0,01…mol
Sau pứ 0,02……..0……………0,01….mol
⇒ m A g = (0,01+0,02).108 = 3,24g
⇒ Chọn C.