Dung dịch HNO3 có pH =2.Tính số mol, nồng độ mol H+ và OH- và pH của dung dịch axit.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


pH = 9,0 ≥ [H+] = 10-9 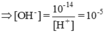
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng (khi pH ≥ 8,3 phenolphtalein đổi màu)

gọi mol CuO là x; Fe2O3 là y
klượng hh= 80x+160y=32g(1)
mCa(OH)2 = 50.7,4:100=3,7->n Ca(OH)2=3,7:74=0,05 mol
hòa tan -hno3 ta được
cuo+ 2hno3 ----> cu(no3)2+ h2o
x => 2x => x
fe2o3+6hno3 -----> 2 fe(no3)3 + h2o
y => 6y => 2y
chung hòa axit
2hno3+ ca(oh)2 ----> ca(no3)2 + 2H2O
0,05 -----> 0,05
m ca(no3)2 = 0,05.164= 8,2g
mà bài cho 88,8 g muối khô
----> m 2 muối còn lại= 88,8- 8,2= 80,6g
hay 188x+ 242.2y= 80,6
từ (1) và (2) giải hệ phương trình ta được:
x= 0,3
y=0,05
=> mol hno3 trong hh đầu là 2.x=2.0,3=0,6 mol=> mhno3( hh đầu)= 0,6.63=37,8g
-----------------------------sau---6.x=6. 0,05=0,3 mol=>---------------sau= 0,3.63=18,9
% axit trong hh đầu :37,8:56,7.100=66,7%
nồng độ mol= 0,9: 0,5=1,8M.

Dung dịch axit ban đầu có [H+] = 0,1 M
⇒ nH+= 0,1.0,1 = 0,01 mol
Dung dịch sau phản ứng có pH = 12
⇒ dư bazơ và có pOH =14 – 12 = 2
⇒ [OH-] = 0,01M
⇒ nOH− dư = 0,002 mol
Phản ứng trung hòa:
nH+phản ứng = nOH−phản ứng = 0,01 mol
⇒ nNaOH ban đầu = nOH−phản ứng + nOH− dư
= 0,01 + 0,002 = 0,012 mol
⇒ a = 0,12M

\(C_{M_{HNO_3}}=0,001M\)
\(\Rightarrow pH=-log\left(H^+\right)=-log\left(0,001\right)=3\)
\(C_{M_{H^+}}=0,001M\)
\(C_{M_{OH^-}}=0,001M\)

Chọn B
Do hai dung dịch HNO 3 và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
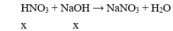
Vậy dung dịch sau phản ứng có pH = 7.
Ta có: \(pH=2\Rightarrow\left[H^+\right]=10^{-2}M\)
\(\Rightarrow\left[OH^-\right]=\frac{10^{-14}}{10^{-2}}=10^{-12}M\)
\(HNO_3\rightarrow H^++NO_3^-\)
Bạn bổ sung thêm đề nhé! Cụ thể là thể tích của dd HNO3 là bao nhiêu nhỉ?