Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

pH = 9,0 ≥ [H+] = 10-9 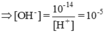
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng (khi pH ≥ 8,3 phenolphtalein đổi màu)

Dung dịch axit ban đầu có [H+] = 0,1 M
⇒ nH+= 0,1.0,1 = 0,01 mol
Dung dịch sau phản ứng có pH = 12
⇒ dư bazơ và có pOH =14 – 12 = 2
⇒ [OH-] = 0,01M
⇒ nOH− dư = 0,002 mol
Phản ứng trung hòa:
nH+phản ứng = nOH−phản ứng = 0,01 mol
⇒ nNaOH ban đầu = nOH−phản ứng + nOH− dư
= 0,01 + 0,002 = 0,012 mol
⇒ a = 0,12M

\(C_{M_{HNO_3}}=0,001M\)
\(\Rightarrow pH=-log\left(H^+\right)=-log\left(0,001\right)=3\)
\(C_{M_{H^+}}=0,001M\)
\(C_{M_{OH^-}}=0,001M\)

Chọn B
Do hai dung dịch HNO 3 và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
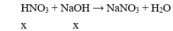
Vậy dung dịch sau phản ứng có pH = 7.

Đáp án D
Dd axit ban đầu có [H+] =0,1 M → nH+=0,1.0,1 =0,01 mol
Dd sau phản ứng có pH = 12 → dư bazo và có pOH =14-12=2 → [OH-] =0,01M→ nOH = 0,002 mol
PTHH: H+ + OH- → H2O
Ta có nNaOH = nH+ + nOH dư = 0,01 + 0,002 = 0,012 mol → a = 0,12M

Đáp án A
Gọi nồng độ ban đầu của Ba(OH)2 là xM
nOH-= 0,2.2x = 0,4 x mol; [OH-] = 10-14/10-13 = 10-1M
[OH-] = 0,4x/ 1,5 = 10-1 suy ra x = 0,375 M

pH=9 => CH+=10-9 và COH-=10-5
Đọo pH của dung dịch có môi trường kiêm nên Phenolphtalein có màu hồng (cái này trong sách giáo khoa 11 có)
Ta có: \(pH=2\Rightarrow\left[H^+\right]=10^{-2}M\)
\(\Rightarrow\left[OH^-\right]=\frac{10^{-14}}{10^{-2}}=10^{-12}M\)
\(HNO_3\rightarrow H^++NO_3^-\)
Bạn bổ sung thêm đề nhé! Cụ thể là thể tích của dd HNO3 là bao nhiêu nhỉ?