Nguyên tử Clo trong tự nhiên có 2 đồng vị \(^{35}_{17}Cl\) và \(^{37}_{14}Cl\) . Biết \(\overline{A}=35,5\)
a) Tính % của từng đồng vị
b) Tính % của \(^{35}Cl\) trong KClO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi phần trăm đồng vị của 35Cl là x
⇒ Phần trăm đồng vị của 37Cl là 100-x
Ta có: \(A=\dfrac{35x+37\left(100-x\right)}{100}=35,5\Rightarrow x=75\%\)
Phần trăm k/lg của 35Cl trong NaCl là:\(\dfrac{35.75\%}{23+35,5}.100\%=44,87\%\)

\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=
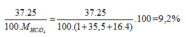
a) Gọi x là thành phần phần trăm của \(_{17}^{35}Cl\)
Ta có: \(\overline{A}=\frac{35x+37\left(100-x\right)}{100}=35,5\leftrightarrow x=75\)
Vậy trong tự nhiên đồng vị \(_{17}^{35}Cl\) chiếm 75% và \(_{17}^{37}Cl\) chiếm 25%
b) Ta có \(\%Cl=\frac{35,5\cdot100}{39+35,5+16\cdot4}=\frac{7100}{277}\sim25,63\%\)
\(\Rightarrow\%^{35}Cl=\frac{25,63\cdot75}{100}=\frac{7689}{400}\sim19,22\%\)