Trộn 100 cm3 khí oxi và 10 cm3 khí hidro, bật tia lửa điện cho phản ứng xảy ra. Tính khối lượng các chất sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


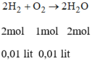
* Chú ý: cùng đktc: tỉ lệ số mol = tỉ lệ thể tích
Tỉ số mol của H 2 và O 2 :
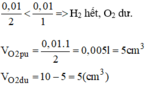
Chọn D

Trong không khí chứa 80% thể tích là khí nito
Vậy thể tích của không khí trong thiết bị trước khi xảy ra phản ứng:
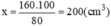
⇒ Chọn A.

$n_{N_2} = 0,04(mol) ; n_{N_2} = 0,14(mol)$
$N_2 + 3H_2 \xrightarrow{t^o,Ni} 2NH_3$
Ta thấy :
$n_{N_2} : 1 < n_{N_2} : 3$ nên hiệu suất tính theo số mol $N_2$
Gọi hiệu suất phản ứng là a
$n_{N_2\ pư} = 0,04a(mol)$
Theo PTHH : $n_{NH_3} = 2n_{N_2} = 0,08a(mol) ; n_{H_2\ pư} = 0,12a(mol)$
Sau phản ứng :
$n_{N_2\ dư} = 0,04 - 0,04a(mol)$
$n_{H_2\ dư} = 0,14 - 0,12a(mol)$
Ta có :
$M_B = \dfrac{(0,04 - 0,04a).28 + (0,14 - 0,12a).2 + 0,08a.17}{0,04 - 0,04a + 0,14 - 0,12a + 0,08a} = 4,375.2$
Suy ra : $a = 0,25 = 25\%$

a) PTHH: 2H2 + O2 -to-> 2H2O
Ta có: \(V_{O_2}=V_{H_2}\)
=> H2 hết, O2 dư.
b) Hỗn hợp khí trên chưa phải hỗn hợp khí nổ mạnh nhất vỉ tỉ lệ thể tích khí H2: O2 chỉ là 1:1 chứ không phải 2:1.

TL:
2H2 + O2 ---> 2H2O
Số mol hh = 6,72/22,4 = 0,3 mol. Khối lượng trung bình hh = 2.11 = 22. Gọi x, y tương ứng là số mol của H2 và O2 trong hh. Ta có hệ:
x + y = 0,3 và 2x + 32y = 22.0,3 = 6,6. Giải hệ thu được x = 0,1; y = 0,2 mol.
Theo pt trên thì O2 dư nên số mol H2O được tính theo số mol H2. Vì hiệu suất là 90% nên số mol H2O = 0,9.0,1 = 0,09 mol. Do đó khối lượng nước = 18.0,09 = 1.62 g.

Gọi số mol của H2 trong hỗn hợp, O2 trong hỗn hợp và H2 tham gia phản ứng lần lược là x, y
Ta có: \(\frac{2x}{32y}=\frac{3}{16}\)
\(\Leftrightarrow3y=x\left(1\right)\)
\(2H_2\left(2y\right)+O_2\left(y\right)\rightarrow2H_2O\left(2y\right)\)
Ta có: \(\frac{x}{2}=\frac{3y}{2}>\frac{y}{1}\) nên O2 phản ứng hết
Ta có số mol hỗn hợp sau phản ứng gồn H2 dứ với hơi nước
\(n_{H_2}=3y-2y=y\)
\(\Rightarrow y+2y=\frac{4,48}{22,4}=0,2\)
\(\Rightarrow y=\frac{1}{15}\)
\(\Rightarrow m_{H_2}=\frac{1}{15}.2=\frac{2}{15}\)
\(\Rightarrow m_{H_2O}=\frac{2}{15}.18=2,4\)
\(2H_2+O_2\rightarrow2H_2O\)
\(\frac{100}{1}>\frac{10}{1}\)
Nên O2 dư
\(V_{O2}=100-\frac{10}{2}=95m^3\)
\(V_{H2O}=V_{H2}=10m^3\)
\(\Rightarrow m_{O2}=0,135\left(g\right)\)
\(\Rightarrow m_{H2O}=0,008\left(g\right)\)