Bài 1: Cho 16,25 g kẽm phản ứng hoàn toàn với dung dịch axit clohidric theo sơ đồ phản ứng :
Zn + 2HCl ➞ ZnCl2 + H2
a) Tính khối lượng axit clohidric đã phản ứng
b) Tính khối lượng muối kẽm clorua ZnCl2
c) Tính thể tích H2 thu được (ở đktc) . (Biết Zn=65, H=1, Cl=35,5)
CÁC BẠN GIÚP MÌNH VỚI, HELP ME!!!!

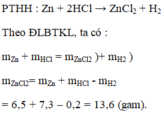
\(n_{Zn}=\frac{16,25}{65}=0,25\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,15__0,5_______0,25___0,25(mol)
a) \(m_{HCl}=0,5.36,5=18,75\left(g\right)\)
b) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
c) \(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
Chúc bạn học tốt
số mol Zn là:\(n_{zn}=16,25:65=0,25\left(mol\right)\)
pthh như trên
\(m_{HCl}=n.M=\left(0,25.2\right).\left(35,5+1\right)=18,25\left(g\right)\)
\(m_{ZnCl_2}=0,25.\left(65+35,5.2\right)=34\left(g\right)\)
\(V_{H_2}=n.22,4=0,25.22,4=5,6\left(l\right)\)