Đồng vị Cu trong tự nhiên là 63Cu và 65Cu có tỉ lệ số nguyên tử là 105:245.
a. Tính nguyên tử khối trung bình của Cu
b. Tính phần trăm khối lượng của 65Cu trong Cu2O
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
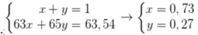
Phần trăm khối lượng của 63Cu trong Cu2O là
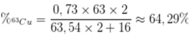

Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
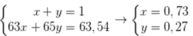
Phần trăm khối lượng của 63Cu trong CuSO4 là
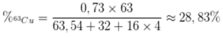

Gọi x là số phần trăm của đồng vị 63Cu
Suy ra phần trăm đồng vị 65Cu là 100 – x
M = [63.x + 65(100 – x)]/100 = 63,546
<=> x = 72,7%
Từ đây dễ dàng tìm được % của 63Cu trong tinh thể CuSO4.5H2O là 18,43%
=> Đáp án D

\(\overline{NTK}_{Cu}=63,54\\ \Leftrightarrow\dfrac{63.x+65.\left(100\%-x\right)}{100\%}=63,54\\ \Leftrightarrow x=73\%\\ \Rightarrow\%m_{\dfrac{^{63}Cu}{CuCl_2}}=73\%.\dfrac{63,54}{63,54+35,5.2}.100\approx34,476\%\)

Đáp án C.
Ta có, gọi % của đồng vị 63Cu = x, thì % đồng vị 65Cu = 100 - x
![]()
=> x = 27,3
%65Cu = 72,7%.
% 63Cu = \(\frac{105}{350}\). 100 = 30%
% 65Cu = 70%
a) Nguyên tử khối trung bình của Cu là\(\frac{\text{63. 30 + 65. 70}}{100}\)= 64,4
b) MCu2O = 64,4. 2 + 16 = 144, 8
%65Cu = \(\frac{\text{2. 65. 70}}{144,8}\) = 62,8%