Dung dich X chứa NaOH 0,1M, KOH 0,1M và Ba(OH)2 0,1M. Tính thể tích dd HNO3 0,2 để trung hòa 100 ml dd X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


B1:
Cho dd NaOH vào hỗn hợp thì dd NaOH sẽ phản ứng với HCl trước sau đó mới phản ứng với muối AlCl3
Để kết tủa là cực đại <=> Không có quá trình hoà tan Al(OH)3
\(NaOH+HCl\rightarrow NaCl+H_2O\\ AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\\ n_{NaOH}=n_{HCl}+3.n_{AlCl_3}=0,01+0,02.3=0,07\left(mol\right)\\ \Rightarrow V_{ddNaOH}=\dfrac{n_{NaOH}}{C_{MddNaOH}}=\dfrac{0,07}{0,1}=0,7\left(lít\right)\)
2)
\(n_{Al_2\left(SO_4\right)_3}=0,0001.V\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,5.0,1=0,05\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,0003.V<--0,0001.V------>0,0003.V-->0,0002.V
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
(0,1-0,0006.V)<-(0,05-0,0003.V)
=> 233.0,0003.V + 78.(0,0008.V-0,1) = 12,045
=> V = 150 (ml)
3) \(n_{K_2SO_4.Al_2\left(SO_4\right)_3.24H_2O}=\dfrac{47,4}{948}=0,05\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{K_2SO_4}=0,05\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,15<-------0,05----------->0,15----->0,1
\(Ba\left(OH\right)_2+K_2SO_4\rightarrow BaSO_4+2KOH\)
0,05---------------------->0,05--->0,1
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
0,1--->0,1
=> mkt = mBaSO4 = 0,2.233 = 46,6(g)

Nồng độ các chất trong 50mL dd X:
NaOH: 0.005 Mol
KOH: 0.005 Mol
Ba(OH)2: 0.01 Mol
Phản ứng của H2SO4 với Ba(OH)2:
H2SO4 + Ba(OH)2 -> BaSO4 + 2H2O
Số mol H2SO4 cần: 0.01 Mol
H+ + OH- -> H2O
Số mol H+ cần: 0.01 Mol => mol H2SO4 cần 0.005 mol.
Lượng mol H2SO4 tổng: 0.015 mol.
=> V H2SO4 = 0.015/0.1 = 0.15 L = 150 mL H2SO4 0.1M

Đặt V (l) là thể tích dung dịch bazo cần tìm.
Ta có:
Mà
+)
(vì có 2 nhóm trong dd ).
Ta có phương trình ion thu gọn sau:
Theo PTHH:

\(n_{H^+}=0.3\cdot0.1\cdot2+0.3\cdot0.15=0.105\left(mol\right)\)
\(n_{OH^-}=0.001V\cdot0.3+0.001V\cdot2\cdot0.1=0.0032V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.105.......0.105\)
\(n_{OH^-\left(dư\right)}=0.0032V-0.105\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.0032V-0.105}{0.3+0.001V}\left(M\right)\)
\(pH=14+log\left[OH^-\right]=12\)
\(\Leftrightarrow log\left[OH^-\right]=-2\)
\(\Leftrightarrow log\left[\dfrac{0.0032V-0.105}{0.3+0.001V}\right]=-2\)
\(\Leftrightarrow V=33.85\left(ml\right)\)
nH+=0,3.0,1.2+0,3.0,15=0,105 mol
nOH- ban đầu =0,3V + 0,1.2V=0,5V mol
Sau phản ứng thu được dung dịch có pH=12
⇒OH- dư ⇒ pOH=2
⇒ [OH- ] dư = 0,01 M
nOH- dư = 0,01(0,3+V)=0,003+0,01V (mol)
nOH- phản ứng=nOH- ban đầu - nOH- dư
= 0,5V - 0,003 - 0,01V
= 0,49V - 0,003 (mol )
H+ + OH- → H2O
0,105 → 0,105
nOH- phản ứng = nH+
⇒0,49V - 0,003 =0,105
⇒ V≃0,22 lít=200ml
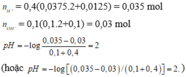
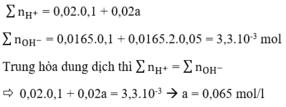
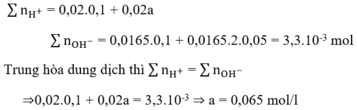
nNaOH = 0,1.0,1=0,01 mol
nBa(OH)2 = 0,1.0,1=0,01 mol
=> nOH- = 0,01+0,01.2=0,03 mol
OH- + H+ = H2O
0,03...0,03
=> nH+ = 0,03 mol
=> V dd HNO3 = 0,03/0,2=0,15 mol