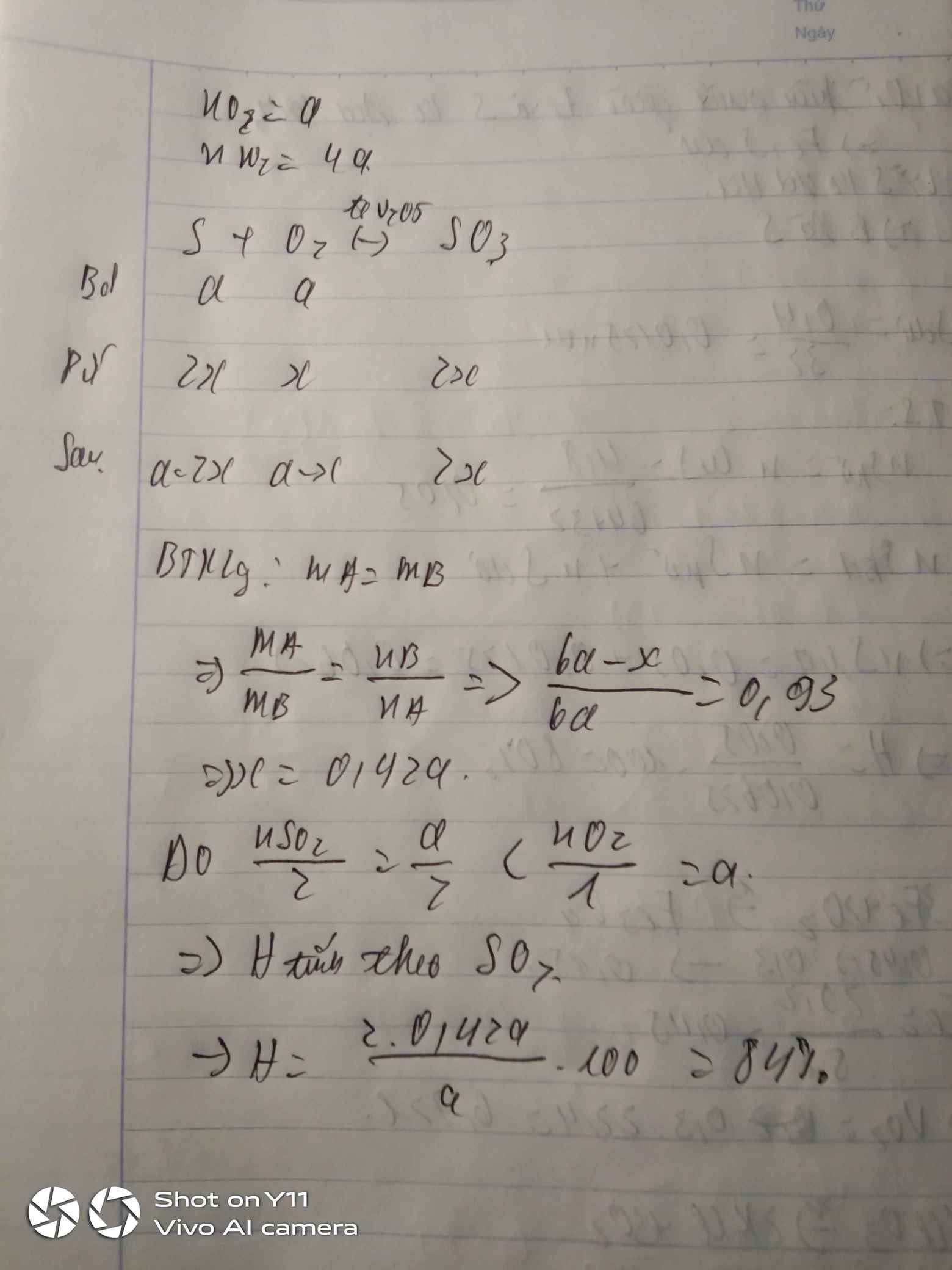đem hỗn hợp A gồm so2 và o2 trong đó so2 chiếm 50% số mol hỗn hợp A, cho qua chất xúc tác đun nóng, sau phản ứng thu được hỗn hợp B trong đó so2 chiếm 35,29% số mol của hỗn hợp B. Tính hiệu suất của phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)

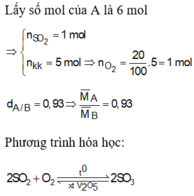
dX/H2 = 24 => trong hỗn hợp khí X , nSO2 = nO2
Đặt nSO2 = nO2 = a mol
2SO2 + O2 -> 2SO3
Đặt nO2 phản ứng = b mol
Sau phản ứng, hỗn hợp Y gồm a-2b mol SO2 , a-b mol O2 và 2b mol SO3 dY/H2 = 30 <=> 64(a-2b)+32(a-b)+80.2b=2.30.(2a-b) => a=5/2b
Phần trăm số mol của O2 trong hỗn hợp Y là: (a-b)/(2a-b) = 37,5%
Đáp án D

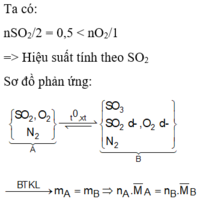
Gọi hiệu suất phản ứng là a
$2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3$
Ta thấy :
V SO2 / 2 = V O2 nên hiệu suất tính theo số mol của SO2 hoặc O2
V SO2 phản ứng = 4,48a(lít)
V O2 phản ứng = 2,24a(lít)
V SO3 = V SO2 pư = 4,48a(lít)
Sau phản ứng, khí gồm :
SO2 : 4,48 - 4,48a(lít)
O2 : 2,24 - 2,24a(lít)
SO3 : 4,48a(lít)
Suy ra :
4,48 - 4,48a + 2,24 - 2,24a + 4,48a = 5,6
=> a = 0,5 = 50%
Hỗn hợp khí gồm :
SO2 : 4,48 -4,48.0,5 = 2,24 lít
O2 : 2,24 - 2,24.0,5 = 1,12 lít
SO3 : 4,48.0,5 = 2,24 lít

\(GS:n_{SO_2}=n_{O_2}=1\left(mol\right)\)
\(SO_2+\dfrac{1}{2}O_2\underrightarrow{^{^{t^0,V_2O_5}}}SO_3\)
Bđ: \(1..........1\)
Pư: \(2a.....a.........2a\)
Kt: \(1-2a...1-a.....2a\)
\(n_{hh}=1-2a+1-a+2a=2-a\left(mol\right)\)
\(\%SO_3=\dfrac{2a}{2-a}\cdot100\%=35.3\%\)
\(\Rightarrow a=0.3\)
\(H\%=\dfrac{0.3\cdot2}{1}\cdot100\%=60\%\)

Ta có : = =1
+→
2x → x → 2x
Hỗn hợp khí gồm dư ( 1 - 2x ) , dư ( 1 - x ) và ( 2x )
⇒ 2x =35,3 % (1 - 2x + 1 - x + 2x )
⇔ x=0,3
Hiệu Suất :
H = ×100 = × 100 = 60%