
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol $SO_2$ và $O_2$ lần lượt là 1 và 1 (Dựa theo tỉ khối hơi)
a, $2SO_2+O_2\rightarrow 2SO_3$
b, $\%V_{SO_2}=\%V_{O_2}=50\%$
Gọi số mol $SO_2$ phản ứng là a (mol)
Sau phản ứng hỗn hợp hơi thu được a mol $SO_3$; $1-0,5a$ mol $O_2$ và $1-a$ mol $SO_2$
Ta có: \(\dfrac{80a+\left(1-0,5a\right).32+\left(1-a\right).64}{a+1-0,5a+1-a}=60\Rightarrow a=0,8\)
Suy ra $\%V_{O_2}=37,5\%;\%V_{SO_2}=12,5\%;\%V_{SO_3}=50\%$

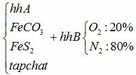
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
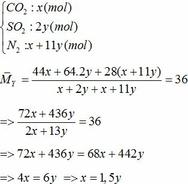
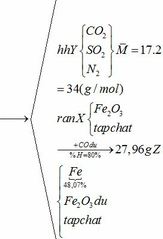
Khối lượng Fe có trong Z là:
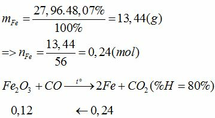
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
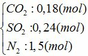
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
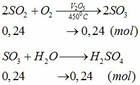
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
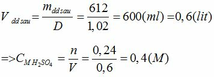

Theo gt ta có: $n_{Cu_2S}=n_{FeS}=0,1(mol)$
Bảo toàn e ta có: $n_{SO_2}=0,95(mol)\Rightarrow V=21,28(l)$
Bảo toàn nguyên tố Cu và Fe ta có: $n_{CuSO_4}=0,2(mol);n_{Fe_2(SO_4)_3}=0,05(mol)$
$\Rightarrow m_{muoi}=52(g)$
Bảo toàn S ta có: $n_{H_2SO_4}=1,1(mol)$
Bảo toàn Cu và Fe ta có: $n_{CuO}=0,2(mol);n_{Fe_2O_3}=0,05(mol)$
$\Rightarrow a=36(g)$
Theo gt ta có: nCu2S=nFeS=0,1(mol)nCu2S=nFeS=0,1(mol)
Bảo toàn e ta có: nSO2=0,95(mol)⇒V=21,28(l)nSO2=0,95(mol)⇒V=21,28(l)
Bảo toàn nguyên tố Cu và Fe ta có: nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)
⇒mmuoi=52(g)⇒mmuoi=52(g)
Bảo toàn S ta có: nH2SO4=1,1(mol)nH2SO4=1,1(mol)
Bảo toàn Cu và Fe ta có: nCuO=0,2(mol);nFe2O3=0,05(mol)nCuO=0,2(mol);nFe2O3=0,05(mol)
⇒a=36(g
ok nha

Theo đề bài, nN2 = 4x (mol)
nO2 = x (mol)
PTHH: 2SO2 + O2 ==(nhiệt,xt)=> 2SO3
Mol:.......x..........x
Phản ứng: a .........0,5a ..............................x
Còn lại: .(x - a) ...(x - 0,5a) .................x
Ta có: nA = nO2 + nSO2 + nN2 = x + x + 4x = 6x (mol)
nB = nSO2 sau pứ + nO2 sau pứ + nSO3 + nN2 = x - a +x - 0,5a + x + 4x = 6x - 1,5a (mol)
Mặt khác, theo định luật bảo toàn khối lượng: mA = mB
Và dA/B = MA\MB=0,925
⇔⇔ mA\nA÷mB\nB=0,925
⇔⇔ nA\nB=0,925
⇔⇔ 6x−0,5a\6x=0,925
⇒⇒ a\x=9\10
⇒H=9\10.100%=90%
Vậy hiệu suất phản ứng là 90%
