Cho 11 gam hỗn hợp AL; Fe phản ứng hoàn toàn với H2SO4 đặc nóng thu được 10,08 lít SO2 sản phẩm khử duy nhất đo ở đktc và dd A. Tính % theo khối lượng của mỗi kim loại trong hỗn hợp. Cho NaOH dư vào dd A thu được m gam một kết tủa, nung kết tủa này ngoài không khí tới khối lượng không đổi thu đc a gam một chất rắn.Tính m và a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


F22: Tính số mol mỗi kim loại ? Biết :
a. 9,96 gam hỗn hợp X ( Fe , Al có tỷ lệ mol 1 : 1) .
Gọi x, y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=9,96\\x=y\end{matrix}\right.\)
=> x=y= 0,12(mol)
b. 27,6 gam hỗn hợp Y ( Fe , Cu có tỷ lệ mol 1 : 2) .
Gọi x, y lần lượt là số mol Fe, Cu
\(\left\{{}\begin{matrix}56x+64y=27,6\\\dfrac{x}{y}=\dfrac{1}{2}\end{matrix}\right.\)
=> x= 0,15; y=0,3
c. 29,52 gam hỗn hợp Z ( Cu, Al có tỷ lệ mol 3 : 2 ) .
Gọi x, y lần lượt là số mol Cu, Al
\(\left\{{}\begin{matrix}64x+27y=29,52\\\dfrac{x}{y}=\dfrac{3}{2}\end{matrix}\right.\)
=> x= 0,36 ; y=0,24
F23: 11 gam hỗn hợp X (Al, Fe) có tổng số mol là 0,3. Tính khối lượng mỗi kim loại ?
Gọi x, y lần lượt là số mol Al, Fe
\(\left\{{}\begin{matrix}27x+56y=11\\x+y=0,3\end{matrix}\right.\)
=> x=0,2 , y =0,1
=> \(\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)

Theo gt ta có: $n_{NO}=0,3(mol)$
Gọi số mol của Al và Fe trong 11g hỗn hợp lần lượt là a;b(mol)
Ta có: \(\left\{{}\begin{matrix}27a+56b=11\\3a+3b=0,9\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
Suy ra $m_{Fe}=5,4(g);m_{Al}=5,6(g)$

Gọi số mol của Al và Fe lần lượt là x và y
Vì số mol của Al gấp 2 lần Fe nên x=2y (1)
Và khối lượng của Fe và Al là 11g nên
27x+56y=12 (2)
Giải HPT: \(\left\{{}\begin{matrix}\text{27x+56y=12 }\\\text{x=2y }\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}\text{x=0,2 mol}\\\text{y=0,1 mol}\end{matrix}\right.\)
\(\rightarrow\)mAl=27.0,2=5,4
mAl=56.0,1=5,6

1)\(Mg+HCl\rightarrow MgCl_2+H_2\)
x____________________x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y ____________________1,5y
Giải hệ phương trình :
\(\left\{{}\begin{matrix}x+\frac{3}{2y}=0,5\\24x+27y=10,2\end{matrix}\right.\rightarrow x=y=0,2\)
\(\%_{Mg}=\frac{0,2.24}{10,2}.100\%=47,1\%\)
\(\rightarrow\%m_{Al}=100\%-47,1\%=52,9\%\)

gọi nfe =x nal =y
bảo toàn khối lượng ta có 56x +27y =11 (1)
bảo toàn e ta có 3x +3y =0,3 nhân 3 (2)
giải hệ phương trình là ra

Đặt \(n_{Fe}=a\left(mol\right)\) \(\Rightarrow n_{Al}=2a\left(mol\right)\)
Ta có: \(56a+27\cdot2a=11\) \(\Leftrightarrow a=0,1\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(3n_{Al}+2n_{Fe}=2n_{H_2}\)
\(\Rightarrow n_{H_2}=0,4\left(mol\right)\) \(\Rightarrow V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\)
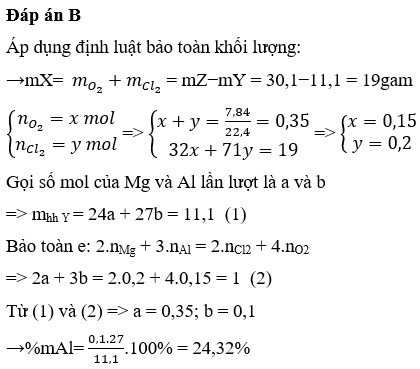
________________________________________
2Al + 6H2SO4 --> Al2(SO4)3 + 6H2O +3SO2
x ---------------------------------------------> 3/2x
2Fe + 6H2SO4 --> Fe2(SO4)3 + 6H2O + 3SO2
y --------------------------------------------------> 3/2y
ta có hệ pt sau
27x + 56y = 11 và 3/2x + 3/2y = 10,08/22,4
<=> x = 0,2 và y = 0,1
=> mFe = 0,1.56 = 5,6 g
=>
Thsm khảo tạm nha
Al2(SO4)3 + 6NaOH --> 2Al(OH)3 + 3Na2SO4
0,1 --------------------------> 0,2
Fe2(SO4)3 + 6NaOH --> 2Fe(OH)3 + 3Na2SO4
0,05 ------------------------> 0,1
=> mKT = 0,2.78 + 0,1.107 = 26,3 g
2Al(OH)3 --> Al2O3 +3H2O
0,2 -----------> 0,1
2Fe(OH)3 --> Fe2O3 + 3H2O
0,1 ------------> 0,05
=> a = 0,1.102 + 0,05.160 = 18,2 g