Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

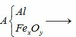
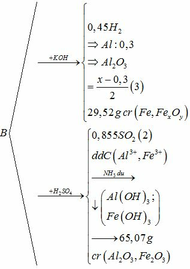
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
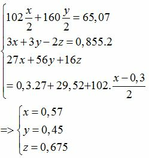
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
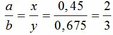
=> Fe2O3

Theo gt ta có: $n_{SO_2}=0,05(mol)$
Bảo toàn e ta có: $n_{FeO}=0,05(mol)$
$\Rightarrow n_{CuO}=0,145(mol)$
$\Rightarrow \%m_{FeO}=23,68\%;\%m_{CuO}=76,32\%$
Bảo toàn Fe và Cu ta có: $n_{Fe_2O_3}=0,025(mol);n_{CuO}=0,145(mol)$
$\Rightarrow m=15,6(g)$
Ta có: \(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Bảo toàn electron: \(n_{FeO}=2n_{SO_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeO}=\dfrac{0,1\cdot72}{15,2}\cdot100\%\approx47,37\%\\\%m_{Cu}=100\%-47,37\%=52,63\%\end{matrix}\right.\)
Mặt khác: \(n_{CuO}=\dfrac{15,2-7,2}{80}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeO}=n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\\n_{CuO}=n_{Cu\left(OH\right)_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=0,1\cdot160+0,1\cdot98=25,8\left(g\right)\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{FeO}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{rắn}=m_{Fe_2O_3}+m_{CuO}=0,1\cdot80+0,05\cdot160=16\left(g\right)\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
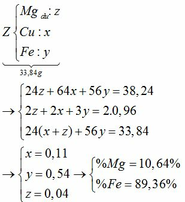

\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$
________________________________________
2Al + 6H2SO4 --> Al2(SO4)3 + 6H2O +3SO2
x ---------------------------------------------> 3/2x
2Fe + 6H2SO4 --> Fe2(SO4)3 + 6H2O + 3SO2
y --------------------------------------------------> 3/2y
ta có hệ pt sau
27x + 56y = 11 và 3/2x + 3/2y = 10,08/22,4
<=> x = 0,2 và y = 0,1
=> mFe = 0,1.56 = 5,6 g
=>
Thsm khảo tạm nha
Al2(SO4)3 + 6NaOH --> 2Al(OH)3 + 3Na2SO4
0,1 --------------------------> 0,2
Fe2(SO4)3 + 6NaOH --> 2Fe(OH)3 + 3Na2SO4
0,05 ------------------------> 0,1
=> mKT = 0,2.78 + 0,1.107 = 26,3 g
2Al(OH)3 --> Al2O3 +3H2O
0,2 -----------> 0,1
2Fe(OH)3 --> Fe2O3 + 3H2O
0,1 ------------> 0,05
=> a = 0,1.102 + 0,05.160 = 18,2 g