Cho 78,3 gam mangan đioxit tác dụng với HCl đặc. Lượng Clo thu được dẫn qua 500ml dd NaOH 4M (ở đk thường) được dd A.
a) Viết pt phản ứng
b) Tính nồng độ mol các chất trong dd A (coi Vdd không thay đổi).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

3)
a) Phương trình phản ứng:
Fe + CuSO4----> FeSO4 + Cu
b)
nFe = 1.96/ 56 = 0.035 (mol)
Khối lượng dung dịch CuSO4 là: m = V. D = 100 x 1.12 = 112 (g)
=> m CuSO4 = 112 x 10% = 11.2 (g)
=> n CuSO4 = 11.2/ 160 = 0.07 (mol)
Fe tác dụng với CuSO4 theo tỉ lệ 1:1 mà nFe < nCuSO4 => Fe hết, CuSO4 dư, như vậy tính toán theo số mol của Fe
Fe + CuSO4----> FeSO4 + Cu
0.035..0.035........0.035.....0.035
=> Nồng độ mol của FeSO4 được tạo thành sau phản ứng trong dung dịch là: 0.035 / 0.1 = 0.35M
Nồng độ mol của CuSO4 dư sau phản ứng là: (0.07 - 0.035)/ 0.1 = 0.35M
2)
3NaOH + FeCl3 --------> Fe(OH)3 + 3NaCl
nNaOH = 0.5*1.8 = 0.9
nFeCl3 bđ = 0.5*0.8 = 0.4
=> nFeCl3 pư = 0.3
=> nFeCl3 dư = 0.1
Chất rắn B là Fe(OH)3
=> mFe(OH)3 = 0.3*107 = 32.1g
Dung dịch A gồm NaCl và FeCl3 dư
Vdd mới = 500 + 500 = 1000ml = 1L
CM NaCl = 0.9M
CM FeCl3 dư = 0.1M

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_{2\downarrow}\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, Ta có: \(n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,8}{0,2}=4\left(M\right)\)
c, Theo PT: \(n_{MgO}=n_{Mg}=0,4\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,4.40=16\left(g\right)\)

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 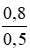
CM (NaOH)dư = 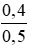
tích cho mình nha![]()

\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
Ta có:
\(n_{MnO2}=\frac{69,2}{55+16.2}=0,8\left(mol\right)\)
Theo phản ứng: \(n_{Cl2}=n_{MnO2}=0,8\left(mol\right)\)
Ta có: \(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}>2n_{Cl2}\Rightarrow\) NaOH dư
\(n_{NaCl}=n_{NaClO}=n_{Cl2}=0,8\left(mol\right)\)
\(n_{NaOH_{Dư}}=2-0,8.2=0,4\left(mol\right)\)
V dung dịch = 500ml = 0,5 lít
\(CM_{NaCl}=CM_{NaClO}=\frac{0,8}{0,5}=1,6M\)
\(CM_{NaOH_{Dư}}=\frac{0,4}{0,5}=0,8M\)
nMnO2= 0.9 (mol)
MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
Từ PTHH:
nCl2= 0.9 (mol)
nNaOH= 2 (mol)
2NaOH + Cl2 --> NaCl + NaClO + H2O
Từ PTHH:
2/2>0.9/1 => NaOH dư
CM NaCl= 0.9/0.5=1.8M
CM NaClO= 0.9/0.5=1.8M
CM NaOH (dư)= (2 -1.8)/0.5=0.4M