Câu 1 : Ngâm một thanh kẽm vào 100ml dung dịch AgNO3 0,1M đến khi AgNO3 tác dụng hết, thì khối lượng thanh kẽm sau phản ứng so với thanh kẽm ban đầu sẽ như thế nào ?
Câu 2 : Ngâm một đinh sắt sạch trong 200ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch rửa sạch nhẹ bằng nước cất và sấy khô rồi đem cân thấy khối lượng đinh sắt tăng 0,8g so với ban đầu. Tính nồng độ mol của dung dịch CuSO4 đã dùng ?
Câu 3 : Cho 0,6g bột magie tác dụng với 100ml dung dịch chứa AgNO3 0,2M và Cu(NO3)2 0,25M. Khuấy đều, khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Tính giá trị của m ?


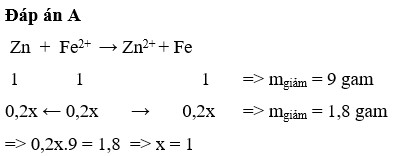
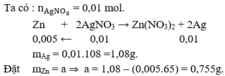
Câu 1:
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(n_{AgNO_3}=C_M\cdot V=0,1\cdot0,1=0,01\)
m Zn tăng = m Ag bám vào - khối lượng Zn phản ứng
\(0,01\cdot108-0,005\cdot65=0,775\left(g\right)\)
Câu 2:
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Theo PTHH, số mol mỗi chất đều bằng nhau, gọi số mol đó là x (mol).
m Fe tăng = m Cu tạo ra - m Fe phản ứng
\(=64x-56x=8x=0,8\left(g\right)\)
\(\Rightarrow x=0,1\left(mol\right)\)
\(C_MCuSO_4=\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5M\)