Cho a (g) Fe hòa tan trong dung dịch HCl ( TN1) sau khi cô cạn dung dịch tu được 3,1 g chất rắn. Nếu cho a(g) Fe và b(g) Mg ( TN2 ) vào dung dịch HCl như trên. sau khi cô cạn dung dịch thì thu được 3,34 g chất rắn và 448ml H2 (đktc ). tính a,b và m muối
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a/
\(Fe_2O_3\left(x\right)+6HCl\left(6x\right)\rightarrow2FeCl_3\left(2x\right)+3H_2O\)
\(CuO\left(y\right)+2HCl\left(2y\right)\rightarrow CuCl_2\left(y\right)+H_2O\)
Gọi số mol của Fe2O3 và CuO lần lược là: x, y
Ta có: \(\left\{\begin{matrix}160x+80y=64\\162,5.2x+135y=124,5\end{matrix}\right.\)
\(\left\{\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
\(\%Fe_2O_3=\frac{160.0,3}{64}=75\%\)
\(\Rightarrow\%CuO=100\%-75\%=25\%\)
b/ \(n_{HCl}=6.0,3+2.0,2=2,2\)
\(m_{HCl}=2,2.36,5=80,3\)
\(m_{ddHCl}=\frac{80,3}{0,2}=401,5\)

Đáp án B
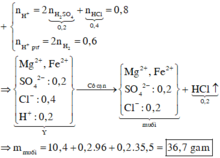
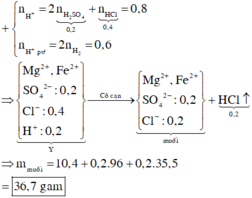
● Chú ý: Tiến hành cô cạn dung dịch chứa HCl, HNO3 thì các axit này sẽ bay hơi vì chúng có nhiệt độ sôi thấp.

Do cùng với khối lượng hỗn hợp kim loại như nhau, nhưng ở thí nghiệm 2 nặng hơn thí nghiệm 1, => ở TN 1 acid phản ứng thiếu.
Gọi nồng độ mol phản ứng của HCl là x
PTHH: \(M+2HCl\rightarrow MCl_2+H_2\uparrow\)
Ta có \(n_{HCl}=0,5x\)
Ta có PT: \(18,6+36,5.0,5.x=34,5+0,25x.2\)
\(\Leftrightarrow18,6+18,25x=34,5+0,5x\)
\(\Rightarrow x\approx0,9C\)
b, ko bt hỏi cái gì :3; kl mỗi kl à

bài 1 :
a)giả sử hỗn hợp chỉ chứa kim loại Mg
=> nHCl =2nMg = 2.0,35 = 0,7mol
giả sử hỗn hợp chỉ chứa kim loại Zn
=> nHCl =2nZn \(\simeq\) 2.0,13 = 0,26mol
=> 0,26mol < nHClpư < 0,7mol
mà nHCl(ban đầu) = 1mol( 1mol>0,7mol)
=> Axit dư
b) Gọi x và y lần lượt là số mol của Zn và Mg trong hỗn hợp :
⇒ 65x + 24y = 8,4 (1)
Do HCl dư nên ta ko quan tâm tới số mol HCl ta có :
Zn(x)=>H2(x)Zn(x)=>H2(x)
Mg(y)=>H2(y)Mg(y)=>H2(y)
nH2=4,4822,4=0,2(mol)nH2=4,4822,4=0,2(mol)
=>x+y=0,2(2)=>x+y=0,2(2)
Giải hệ ( 1),(2) có :
x=18205=nZn;y=23205=nMg
=>mZn=18205.65=5,7(g)
nMg=23205.24=2,7(g)
bài 2 :
PTHH : Mg + H2SO4 -> MgSO4 + H2 (1)
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (2)
500ml =0,5(l)=>nH2SO4 = 0,5 (mol)
Gọi số mol của Mg , Al lần lượt là x,y (mol) với x,y>0
Theo(1) , nH2SO4 = x (mol)
Theo (2),nH2SO4 = 32y(mol)32y(mol)
Giả sử H2SO4 phản ứng hết => x+32y=0,532y=0,5=> x+y >0,5 (*)
Theo bài ra : 24x + 27y =7,8
<=>24x+24y = 7,8 - 3y
=> 24(x+y) < 7,8
=> x+y < 7,824=0,3257,824=0,325 , mâu thuẫn với (*) => H2SO4 dư <=> axit dư
b, nH2= 8,96/22,4 =0,4 (mol) . Theo (1) và (2) =>x+32y=0,432y=0,4
Vì axit dư nên kim loại hết
suy ra ta có hệ
⎧⎩⎨x+32y=0,424x+27y=7,8⇔{x=0,1y=0,2{x+32y=0,424x+27y=7,8⇔{x=0,1y=0,2
=> mMg = 2,4 (g)
=> mAl = 5,4 (g)
% mMg = 2,47,8.100%≈30,77%2,47,8.100%≈30,77%
%mAl = 69,23%

Chọn D.
Các ion cùng tồn tại được trong cùng một dung dịch là khi chúng không phản ứng với nhau.
Theo đề ta chọn Y (H+, NO3–, SO42–, Mg2+) vì nó thoả mãn được điều kiện là Y hoà tan được Fe2O3 và bảo toàn điện tích.
Vậy dung dịch X là các ion còn lại (K+, Na+, HCO3–, CO32–)
Khi cô cạn X thì HCO3– bị phân huỷ thành CO32– (0,05 mol)
Þ m=23,6g