Thả 1 thanh sắt vào 200ml dung dịch chứa 0,2 mol cuso4 sau 1 thời gian phản ứng lấy thanh sắt ra thấy khối lượng tăng 0,08g. Hỏi lượng sắt và lượng cuso4 tham gia phản ứng là bao nhiêu g?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đổi 200ml= 0,2l
Khối lượng đồng bám vào \(=203,2-200=3,2\left(g\right)\)
Đặt số mol của đồng là x
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x_____ x______ x_________ x
Ta có : \(64x+56x=3,2\)
\(\rightarrow8x=3,2\rightarrow x=0,4\)
\(\rightarrow m=0,4.46=22,4\left(g\right)\)
\(\rightarrow CM_{CuSO4}=\frac{0,4}{0,2}=2M\)

\(Fe\left(x\right)+CuSO_4\rightarrow FeSO_4+Cu\left(x\right)\)
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x
\(64x-56x=51-50=1\)
\(\Leftrightarrow x=0,125\)
\(\Rightarrow m_{Fe\left(pứ\right)}=56.0,125=7\)

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)

PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Đặt \(n_{Fe\left(phản.ứng\right)}=x\left(mol\right)=n_{Cu\left(tạo.ra\right)}\)
\(\Rightarrow64x-56x=0,8\) \(\Rightarrow x=0,1\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(phản.ứng\right)}=0,1\cdot56=5,6\left(g\right)\\m_{Cu\left(tạo.ra\right)}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)

Fe + CuSO4 → FeSO4 + Cu
Gọi x là số mol Fe phản ứng
\(\Rightarrow m_{Fe}=56x\left(g\right)\)
Theo pt: \(n_{Cu}tt=n_{Fe}pư=x\left(mol\right)\)
\(\Rightarrow m_{Cu}tt=64x\left(g\right)\)
Ta có: \(m_{Cu}tt-m_{Fe}pư=m_{kl}tăng\)
\(\Leftrightarrow64x-56x=0,2\)
\(\Leftrightarrow8x=0,2\)
\(\Leftrightarrow x=0,025\)
Vậy \(n_{Fe}pư=0,025\left(mol\right)\Rightarrow m_{Fe}pư=0,025\times56=1,4\left(g\right)\)
\(m_{Cu}tt=0,025\times64=1,6\left(g\right)\)
Fe + CuSO4 → FeSO4 + Cu↓
Gọi số mol Fe phản ứng là \(x\)
\(\Rightarrow m_{Fe}=56x\left(g\right)\)
Theo pt: \(n_{Cu}tt=n_{Fe}pư=x\left(mol\right)\)
\(\Rightarrow m_{Cu}tt=64x\left(g\right)\)
Ta có: \(m_{Cu}tt-m_{Fe}pư=m_{kl}tăng\)
\(\Leftrightarrow64x-56x=0,2\)
\(\Leftrightarrow8x=0,2\)
\(\Leftrightarrow x=0,025\)
Vậy \(n_{Fe}pư=0,025\left(mol\right)\)
\(\Rightarrow m_{Fe}pư=0,025\times56=1,4\left(g\right)\)
\(m_{Cu}tt=0,025\times64=1,6\left(g\right)\)

Chọn đáp án B
n C u S O 4 p ư = 0 , 2 . 80 100 = 0 , 16 m o l
PTHH: M g + C u S O 4 → M g S O 4 + C u
Số mol: 0,16…0,16……..0,16
Sau phản ứng với dung dịch C u S o 4 khối lượng thanh kim loại là:
m 1 =m-24.0,16+64.0,16=m+6,4 (g)
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
2 M g ⏟ x m o l + O 2 → 2 M g O
2 C u ⏟ 0 , 16 + O 2 → C u O
m O 2 (m + 12,8) – ( m + 6,4) = 6,4 → n O 2 =0,2 mol
0,5x + 0,08 = 0,2 x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
0,24 . 24+ 0,16 . 64 = 16 gam

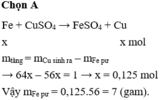
Fe + CuSO4 -> FeSO4 + Cu (1)
Đặt nFe tham gia PƯ =a
Ta có:
64a-56a=0,08
=>a=0,01
mFe=56.0,01=0,56(g)
mCuSO4=160.0,01=1,6(g)