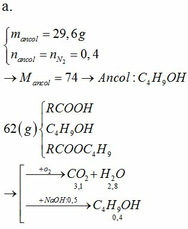
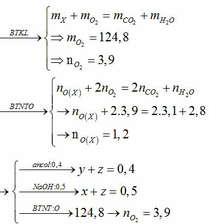
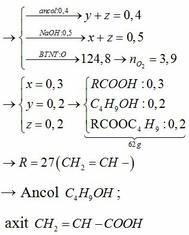
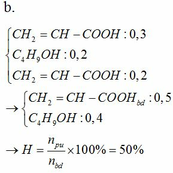Đốt cháy hoàn toàn 6,9 gam một rượu A có công thức CnH2n+1OH. Sau phản ứng thu được 6,72 lít CO2 (ĐKTC). Tìm CTPT của rượu A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
Đốt 2,54 g A tạo ra 0,12 mol CO2 và 0,07 mol H2O
Bảo toàn khối lượng => mO (trong A) = 2,54 - 0,12.12 - 0,07.2 = 0,96
=> nO = 0,06
=> C : H : O = 12 : 14 : 6
Cứ 0,1 mol A phản ứng với 0,3 mol NaOH => A chứa 3 chức este
=> A có 6 oxi hay công thức của A là C12H14O6
Vì axit đơn chức => rượu 3 chức => nancol = 0,1
Đốt 0,1 mol ancol tạo 0,3 mol CO2 => Ancol là C3H5(OH)3
=> Axit là C2H3COOH
=> A là (C2H3COO)3C3H5

Gọi số mol của rượu, axit trong mỗi phần là a, b (mol)
- Phần 1:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2CnH2n+1OH + 2Na --> 2CnH2n+1ONa + H2
a---------------------------------->0,5a
2CmH2m+1COOH + 2Na --> 2CmH2m+1COONa + H2
b----------------------------------------->0,5b
=> 0,5a + 0,5b = 0,15 (1)
- Phần 2: \(n_{CO_2}=\dfrac{39,6}{44}=0,9\left(mol\right)\)
Bảo toàn C: an + b(m+1) = 0,9
=> an + bm + b = 0,9 (2)
- Phần 3:
PTHH: CnH2n+1OH + CmH2m+1COOH -H2SO4(đ),to-> CmH2m+1COOCnH2n+1 + H2O
Este có CTPT là Cm+n+1H2m+2n+2O2
=> m + n = 4 (*)
Ta có: \(n_{este\left(tt\right)}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
Nếu hiệu suất là 100% => \(n_{este\left(lý.thuyết\right)}=\dfrac{0,05.100}{50}=0,1\left(mol\right)\)
- TH1: Axit dư
=> Tính theo số mol của rượu
\(n_{C_nH_{2n+1}OH}=a=n_{este\left(lý.thuyết\right)}=0,1\left(mol\right)\)
=> b = 0,2 (mol) (thỏa mãn)
(2) => 0,1n + 0,2m = 0,7 (**)
(*)(**) => n = 1; m = 3
=> CTPT: \(\left\{{}\begin{matrix}Rượu:CH_3OH\\Axit:C_3H_7COOH\end{matrix}\right.\)
- TH2: Rượu dư
=> Tính theo số mol axit
\(n_{CH_3COOH}=b=0,1\left(mol\right)\)
=> a = 0,2 (mol) (thỏa mãn)
(2) => 0,2n + 0,1m = 0,8 (***)
(*)(***) => n = 4; m = 0 (Vô lí)
- TH3: Pư vừa đủ
=> a = b (3)
(1)(3) => a = b = 0,15 (mol)
(2) => 0,15n + 0,15m = 0,75 (****)
(*)(****) => Vô nghiệm

n CO2 = 0,6 mol => m CO2 = 0,6 . 44 = 26,4 g
n H2O = 0,8 mol
=> n ancol = 0,8 – 0,6 = 0,2 mol
Bảo toàn khối lượng : m Oxy + m hỗn hợp = m CO2 + m H2O
=> m oxy + 15,2 = 26,4 + 14,4 => m Oxy = 25,6 g => n O2 = 0,8 mol
Bảo toàn nguyên tố oxy : n O ( trong hỗn hợp ) + 2 n O2 ( đốt cháy ) = n CO2 . 2 + n H2O
=> 2 n axit + n ancol + 0,8 . 2 = 0,8 + 0,6 .2
=> n Axit = 0,1 mol ( vì n ancol = 0,2 mol )
=> n axit . ( n + 1 ) + n ancol . m = n CO2
=> 0,1 . (n + 1 ) + 0,2 . m = 0,6
=> n +2 m = 5
TH1 m = 2 thì n = 1 TH2: m = 1 thì n = 3
C2H5OH và CH3COOH ( loại vì có số C giống nhau đều là 2 C )
hoặc C3H7COOH và CH3OH ( chọn )
C3H7COOH + CH3OH → C3H7COOCH3 + H2O
0,1 0,2 => 0,1 mol
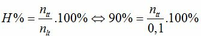
=> n thực tế = 0,09 mol
=> m C3H7COOCH3 = 0,09 . 102 = 9,18 g

\(Đặt:C_nH_{2n+2}O\left(n\ge2\right)\\ n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ C_nH_{2n+2}O\Rightarrow CTPT:C_3H_8O\)

Đáp án D
nCO2 = 0,3 mol => nC = nCO2 = 0,3 mol
nH2O = 0,45 mol => nH = 2nH2O = 0,9 mol
C : H = 0,3 : 0,9 = 1 : 3
Quan sát đáp án => C3H9N

Đáp án D
nCO2 = 0,3 mol
=> nC = nCO2 = 0,3 mol
nH2O = 0,45 mol
=> nH = 2nH2O = 0,9 mol
C : H = 0,3 : 0,9 = 1 : 3
Quan sát đáp án
=> C3H9N

Đáp án D
nCO2 = 0,3 mol => nC = nCO2 = 0,3 mol
nH2O = 0,45 mol => nH = 2nH2O = 0,9 mol
C : H = 0,3 : 0,9 = 1 : 3
Quan sát đáp án => C3H9N