Giúp em bài này với ạ
Hoà tan 6,72g Al vào 500ml đe AgNO3 0,12M và dung dịch Cu(NO3)2 0,16M được m gam chất rắn. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:
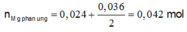
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam

Đáp án A
Vì T chứa 3 kim loại nên T chứa Cu, Ag và Fe dư (Al phản ứng trước Fe).
Khi đó Al, Cu2+ và Ag+ phản ứng hết.
Khi cho T phản ứng với HCl dư, chỉ có Fe phản ứng
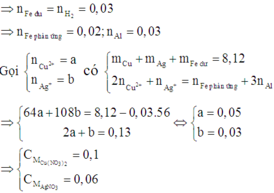

\(n_{Ag+}=0,036mol, n_{Cu2+}=0,024mol\)
Khối lượng Cu, Ag sinh ra tối đa là 0,036.108+0,024.64=5,424(g) > 4,21 gam
Suy ra hh A tan hết vào trong dung dịch, 4,21g rắn X sinh ra chỉ gồm Ag và có thể có Cu.
Lượng Ag sinh ra tối đa là 0,036.108=3,888 (g) <4,21 gam
suy ra rắn X có 3,888 gam Ag và 4,21-3,888=0,322 gam Cu
Lượng Cu2+ còn lại trong dung dịch Y là 0,024.64-0,322=1,214(g)
Bảo toàn điện tích, ta thấy dd Y có số mol điện dương là \(n_{\left(+\right)ddY}=n_{NO3-}=1.n_{Ag}+2.n_{Cu2+}=0,036+0,024.2=0,084\left(mol\right)\)
Trong khi đó lại cho tới 0,08 mol Mg vào dd Y, nên chắc chắn Mg sẽ dư. suy ra rắn Z gồm toàn bộ m gam hỗn hợp A ban đầu, Cu và Mg dư
\(m_{Mg dư}=24\left(0,08-\frac{0,084}{2}\right)=0,912\left(g\right)\)
Vậy \(m=m_Z-m_{Cu}-m_{Mg dư}=4,826-0,912-1,214=2,7\left(g\right)\)
Vì Ag < Cu nên Al sẽ tác dụng với AgNO3 trước còn dư thì sẽ tác dụng tiếp với Cu(NO3)2
dúng chất hết chất dư là ra Kết quả là 16,37 g