Nguyên liệu, nhiêu liệu để sản xuất canxi oxit là gì?
Viet PTPƯ của các phản ứng xảy ra trong quá trình sản xuất canxi oxịt( quá trình nung vôi)
Nêu ưu điểm, nhược điểm của lò nung vôi thủ công và lò nung vôi công nghiệp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Các đặc điểm của phản ứng hoá học nung vôi :
- Phản ứng thuận nghịch.
- Phản ứng thuận thu nhiệt.
- Phản ứng thuận có sản phẩm tạo thành là chất khí.
b) Những biện pháp kĩ thuật để nâng cao hiệu suất nung vôi:
- Chọn nhiệt độ thích hợp.
- Tăng diện tích tiếp xúc của chất rắn (CaC O 3 ) bằng cách đập nhỏ đá vôi đến kích thước thích hợp.
- Thổi không khí nén (trong công nghiệp) hay chọn hướng gió thích hợp để tăng nồng độ khí oxi cung cấp cho phản ứng đốt cháy than, đồng thời làm giảm nồng độ khí cacbon đioxit.

a) mCaCO3 = mCaO + mCO2
b) Khối lượng của CaCO3 đã phản ứng:
140 + 110 = 250 kg
Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi:
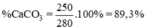

Đáp án C
Các quá trình a, c, d xảy ra sự biến đổi từ chất này thành chất khác.
Cụ thể:
- Đốt cháy than trong không khí có phản ứng như sau:
Than + oxi → t 0 khí cacbonic + hơi nước
- Phản ứng xảy ra khi nung vôi:
Đá vôi → t 0 vôi sống + khí cacbonic.
- Phản ứng xảy ra khi tôi vôi:
Vôi sống + nước → vôi tôi.

Đáp án C
Dùng không khí nén (tăng nồng độ, tăng áp suất) => Tốc độ phản ứng tăng.
Dùng không khí nóng (tăng nhiệt độ) => Tốc độ phản ứng tăng.
Nung đá vôi ở nhiệt độ cao (tăng nhiệt độ) => Tốc độ phản ứng tăng.
Nghiền nguyên liệu => Tăng diện tích tiếp xúc => Tốc độ phản ứng tăng.
Pha loãng dung dịch hỗn hợp phản ứng bằng nước => Nồng độ chất phản ứng giảm => Tốc độ phản ứng giảm.
Các yếu tố làm tăng tốc độ phản ứng là: 1, 2, 3.

a) Dùng không khí nén có nồng độ oxi cao và không khí đã nóng sẵn thổi vào lò cao nên tốc độ phản ứng tăng.
b) Lợi dụng yếu tố nhiệt độ (tăng nhiệt độ)
c) Lợi dụng yếu tố diện tích tiếp xúc (tăng diện tích tiếp xúc của nguyên liệu)

\(1,2NaHCO_3\xrightarrow{t^o}Na_2CO_3+H_2O+CO_2\uparrow\\ 2,CaCO_3\xrightarrow{t^o}CaO+CO_2\uparrow\\ 3,Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\)
1. Nhiệt phân NaHCO3 để sản xuất xôđa.
NaHCO3è Na2CO3+H2O+CO2(nhiệt độ)
2. Nung CaCO3 để sản xuất vôi.
CaCO3=>CaO+CO2
3. Dùng khí CO khử Fe2O3 trong quá trình luyện gang.
3CO+Fe2O3=>2Fe+3CO2

a) CaCO3 --to--> CaO + CO2
Theo ĐLBTKL: mCaCO3 = mCaO + mCO2 (1)
b) (1) => mCaCO3 = 150 + 120 = 270 (kg)
=> \(\%CaCO_3=\dfrac{270}{300}.100\%=90\%\)
a, PTHH:
\(CaCO_3\underrightarrow{t^o}2CaO+CO_2\)
\(mCaCO_3=mCaO+mCO_2\)
b,\(mCaCO_3=mCaO+mCO_2=150+120=270kg\)
\(\Rightarrow\%CaCO_3=\dfrac{270}{300}.100=90\%\)
vậy...
Nguyên liệu để sản xuất canxi oxit là đá vôi (chứa CaCO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
Các phản ứng hóa học xảy ra khi nung vôi:
- Than cháy sinh ra khí CO2 và tỏa nhiều nhiệt
C + O2 → CO2
- Nhiệt sinh ra phân hủy đá vôi ở khoảng trên 9000C
CaCO3 → CaO + CO2
CaO có những ứng dụng chủ yếu sau đây:
- Phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học.
- Canxi oxit còn được dùng để khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm, khử độc môi trường,…
- Canxi oxit có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.