Cho 8 gam SO3 vào bình đựng 18 gam nước thu được hỗn hợp chất lỏng A. Cho tiếp từ từ đến hết 6,9 gam kim loại natri vào bình. Sau khi phản ứng kết thúc thu được dung dịch B ở trong bình và V lít khí C. ( Coi nước bay hơi không đáng kể, thể tích khí đo ở điều kiện tiêu chuẩn).
a. Tính thể tích khí C thu được.
b. Tính khối lượng các chất còn lại trong bình sau phản ứng.
c. Nhúng giấy quỳ tím vào dung dịch B, nêu hiện tượng quan sát được? Giải thích?.



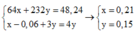

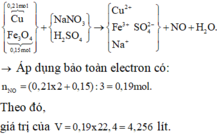
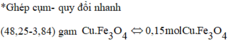
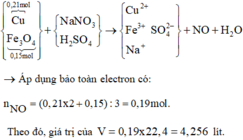

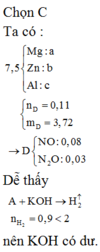
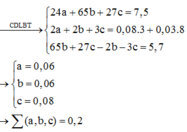
a)
$SO_3 + H_2O \to H_2SO_4$
$n_{SO_3} = \dfrac{8}{80} = 0,1 > n_{H_2O} = 1(mol)$ nên nước dư.
$n_{H_2SO_4} = n_{SO_3} = 0,1(mol)$
$n_{Na} = \dfrac{6,9}{23} = 0,3(mol)$
2Na + H2SO4 → Na2SO4 + H2
0,2.........0,1..............0,1......0,1....(mol)
2Na + 2H2O → 2NaOH + H2
0,1.......................0,1...........0,05.....(mol)
$V_{H_2} = (0,1 + 0,05).22,4 = 3,36(lít)$
b)
$m_{Na_2SO_4} = 0,1.142 = 14,2(gam)$
$m_{NaOH} = 0,1.40 = 4(gam)$
c)
Quỳ tím hóa xanh do dung dịch có bazo