cho 7,22g hỗn hợp X gồm fe và kim loại R có hóa trị không đổi. chia hỗn hợp thành 2 phần bằng nhau. hòa tan hết phần 1 trong dung dịch hcl, được 2,218l h2 (đktc). hòa tan hết phần 2 trong dung dịch hno3 được 1,792l khí no duy nhất (đktc)
a) xác định R
b) tính thành phần phần trăm của khối lượng mỗi loại

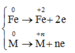
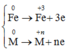
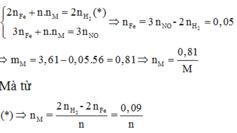
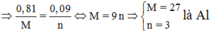
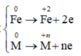
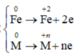
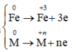
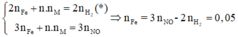
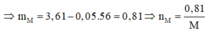
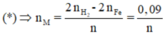
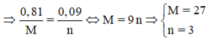
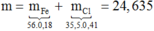

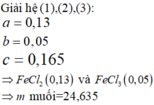
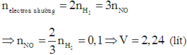
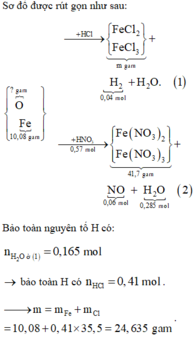
phần 1:
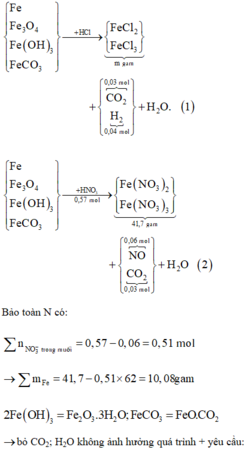
Fe[0]--->Fe[+2] + 2e
x------------------------2xmol
R[0]----->R[+n] + ne
y---------------------->yn mol
2H[+] + 2e---->H2[0] (nH2=0.095 mol)
----------0.19<----0.095mol
====> theo đl bảo toàn e: 2x + yn= 0.19 mol (1)
Phần 2:
Fe[0]---->Fe[+3] + 3e
x------------------------->3x mol
R[0]----->R[+n] + ne
y---------------------->yn mol
N[+5] + 3e---->N[+2] ( nNO= nN[+2] =0.08 mol)
-----------0.24<----0.08mol
====>theo đl bảo toàn e: 3x + yn=0.024 (2)
Lấy (2) trừ (1) ta được: x=0.05mol
**** Cả hai phần R phản ứng đều ở mức oxh [+n] nên em không cần quan tâm đến nó. Nếu đây là bài toán trắc nghiệm em có thể tính nhanh số mol Fe mỗi phần bằng cách ( khỏi phải viết mấy cái quá trình như trên dài lắm em nhá) :
n Fe = ( 3nNO) - (2nH2) =0.05 mol
Khối lượng mỗi phần = 7.22/2=3.61 g
=>m(R)= 3.61 - (0,05*56)=0.81 g
=>%mR= 0.81/3.61=22,4%
thế các số liệu vào ( phần 1)
Fe[0] -----.Fe[+2] + 2e
0.05------------------------0.1mol
R[0] -----R[+n] + ne
0.81/R--------------0.81n/R
2H[+] + 2e---->H2[0]
----------0.19<----0.095mol
Theo đl bảo toàn e: 0.1 + 0.81n/R = 0.19
=>R=9n
n=1 ==>R= 9 (l)
n=2 ==>R= 18(l)
n=3 ==>R=27( nhận)
.....
Vậy R là Al
cách 2 bài 1
KL M hóa trị n
Gọi x và y là số mol của Fe và KL M sau khi chia thành 2 phần và n là hóa trị của M
2x + ny = (2,128/22,4) *2
3x + ny = (1,792/22,4) *3
=>x= 0,05 ; ny = 0,09
m X =7,22/2=3,61 = 56x + My = 3,61 =>56*0,05 + My = 3,61 => My =0,81 ta có ny =0,09
lấy My/ny=0,81/0,09 <=>M/n =9
Ta có: M= 9n =>chọn M=27,n=3 .Vậy kim loại M là Al