Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
Phần 1
\(n_{H2}=\frac{1,792}{22,4}=0,08\left(mol\right)\)
Bảo toàn e ta có
\(n_{e\left(nhuong\right)}=0,08.2=0,16\left(mol\right)\)
Phần 2
Bảo toàn e ta có
\(n_{e\left(nhuong\right)}=4n_{O2}\Rightarrow n_{O2}=\frac{0,16}{4}=0,04\left(mol\right)\)
Theo ĐLBLKL
\(m_{kl}+m_{O2}=m_{oxit}\Rightarrow m_{kl}=1,56\)
\(\Rightarrow m_{hh\left(bđ\right)}=1,56.2=3,12\left(g\right)\)
Câu 2:
PT thu gọn:
\(Mg+2H^+\rightarrow Mg+H_2\)
\(Al+6H^+\rightarrow Al+3H_2\)
\(n_{H2}=\frac{5,32}{22,4}=0,2375\left(mol\right)\)
\(\Rightarrow n_{H^+\left(pu\right)}=0,2375.2=0,475\left(mol\right)\)
\(n_{H^+\left(dư\right)}=n_Y=n_{H^+\left(đc\right)}-n_{H^+\left(pư\right)}\)
\(=0,25.\left(1+0,5.2\right)-0,475\)(H2SO4 có hai H nên x2)
\(=0,025\left(mol\right)\)
\(CM_Y=\frac{0,025}{0,25}=0,1M\)
\(pH_{\left(ddY\right)}=-log\left(0,1\right)=1\)

Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là 3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Qúa trình nhường electron:
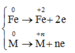
Quá trình nhận electron:
![]()
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường electron
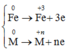
Quá trình nhận electron:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
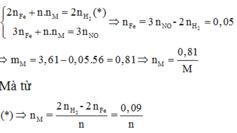
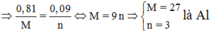

Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là nH2=3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Quá trình nhường e:
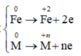
Quá trình nhận e:
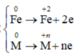
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường e:
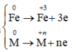
Quá trình nhận e:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
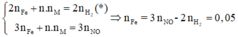
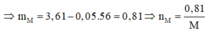
Mà từ
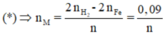
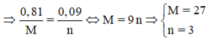
Là Al

Ta có: mKL (trong 1 phần) = 6,48:2 = 3,24
- Phần 1:
m muối = mKL + mCl- \(\Rightarrow n_{Cl^-}=\dfrac{16,02-3,24}{35,5}=0,36\left(mol\right)\)
BTNT Cl: nHCl = nCl- = 0,36 (mol)
BTNT H: nH2 = 1/2nHCl = 0,18 (mol)
\(\Rightarrow V_{H_2}=0,18.22,4=4,032\left(l\right)\)
- Phần 2:
BT e, có: 2nZn + 2nMg + 3nAl = 2nH2 = 4nO2
⇒ nO2 = 0,09 (mol)
⇒ m oxide = mKL + mO2 = 3,24 + 0,09.32 = 6,12 (g)
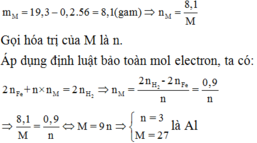

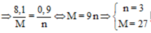

Theo gt ta có: $n_{H_2}=0,08(mol)$
Bảo toàn e ta có: $n_{e}=0,16(mol)\Rightarrow n_{O_2}=\frac{n_e}{4}=0,04(mol)$
Do đó $m_{kl}=2,84-0,04.32=1,56(g)$
Suy ra $m_{klbđ}=2.1,56=3,12(g)$
Đặt M là KL chung có hóa trị là n
nH2=0,08
2M + 2nHCl --> 2MCln + nH2
0,16/n <-- 0,16 <-- 0,16/n <--0,08
4M + nO2 --> 2M2On
0,16/n --> 0,08/n
Bảo toàn nguyên tố Oxi: nO trong M2On = (0,08/n).n= 0,08 mol
-> nO2=0,08/2=0,04 mol --> mO2= 0,04.32=1,28g
Bảo toàn khối lượng: mM = mM2On - mO2= 2,84-1,28= 1,56g