X là hỗn hợp 2 kim loại Mg và Zn, Y là dung dich H2SO4 chưa rõ nồng độ.
Thí nghiệm 1 : cho 24,3 gam X vào 2 lít Y, sinh ra 8,96 lít H2.
Thí nghiệm 2 : Cho 24,3 gam X vào 3 lít Y, sinh ra 11,2 lít khí H2.
Các thể tích đều đo ở đktc.
Chứng minh rằng trong thí nghiệm 1 thì X chưa tan hết, trong thí nghiệm 2 thì X tan hết.

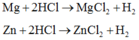
ta có: khối lượng kim loại ở 2 TN giữ nguyên khi tăng lượng axit thì lượng H2 thoát ra cũng tăng lên.
=> TN1 : hỗn hợp X chưa tan hết.
ta có\(\dfrac{V_{HCl\left(TN2\right)}}{V_{HCl\left(TN1\right)}}=\dfrac{3}{2}=1,5\);
\(\dfrac{V_{H2\left(TN2\right)}}{V_{H2\left(TN1\right)}}=\dfrac{11,2}{8,96}=1,25\)
TN2: ta thấy khối lượng axit tăng 1,5 lần còn khối lượng H2 thoát ra tăng 1,25 lần.
=> TN2: hỗn hợp X tan hết.
Bạn ơi cho mình hỏi : Tại sao thấy khối lượng axit tăng 1,5 lần còn khối lượng H2 thoát ra tăng 1,25 lần thì Hỗn hợp X tan hết vậy ?