Để hòa tan 3,9g kim loại X cần dùng thể tích (ml) dd HCl và có 1,344l Hiđro bay ra(dktc). Mặt khác để hòa tan 3,2g oxit kim loại Y nặng a gam. Nung Y cũng cần dùng thể tích (ml) dd HCl ở trên. Hoi X,Y là kim loại gì?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2X +2a HCl \(\rightarrow\)2XCla + aH2 (1)
nH2=\(\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Theo PTHH 1 ta có:
nX=\(\dfrac{a}{2}\)nH2=0,03a(mol)
=>MX=\(\dfrac{3,9}{0,03a}=\dfrac{130}{a}\)
Vì X là kim loại nên a=1;2;3
Ta có bảng:
| a=1 | X=130(loại) | |
| a=2 | X=65(chọn) | |
| b=3 | X=43.3(loại) |
Vậy X là kẽm,KHHH là Zn
nHCl đã PƯ=2nH2=0,12(mol)
2Y +2a HCl \(\rightarrow\)2YCla + aH2 (2)
Theo PTHH 2 ta cso:
nY=\(\dfrac{1}{a}\)nHCl=\(\dfrac{0,12}{a}\)
MY=\(\dfrac{3,2}{\dfrac{0,12}{a}}\)

- Thí nghiệm 1: Gọi hóa trị của X là n
CÓ n H2 = 0,06 ( mol ) => n HCL = 0,12 ( mol )
PTHH: 2X +2n HCL ===> 2XCLn + nH2
theo pthh: n X = 0,12/n ( mol )
=> X = 32,5n
Xét: n = 2 => X = 65 ( Zn )
- Thí nghiệm 2
Gọi CT của oxit : YaOb
PTHH
\(YaOb+2bHCL\rightarrow aYCl_{\dfrac{2b}{a}}+bH2O\)
theo pthh: n YaOb = 0,06/b ( mol )
=> aY + 16b = 160/3 . b
=> Y = 56 . 2b/a
Xét: 2b/a = 3 => Y = 56 ( Fe )

Thể tích dung dịch HCl dùng cho cả 2 phản ứng bằng nhau, nên có cùng số mol. Kí hiệu X, Y là khối lượng mol nguyên tử của 2 kim loại.
Phương trình hoá học của phản ứng :
2X + 2nHCl → 2X Cl n + n H 2 ↑
n H 2 = 0,672 /22,4 = 0,03 mol
Theo đề bài: 0,06/n x X = 1,95 → X = 32,5n
Kẻ bảng
| n | 1 | 2 | 3 |
| X | 32,5 | 65 | 97,5 |
Vậy X là Zn
Y 2 O m + mHCl → Y Cl m + m H 2 O
Theo đề bài, ta có:
(2Y + 16m) = 1,6 → Y = 56/3.m
Kẻ bảng
| m | 1 | 2 | 3 |
| Y | 56,3 | 112/3 | 56 |
Vậy Y là Fe.

Để hòa tan hoàn toàn 7,8 gam kim loại A càn dùng V ml dung dịch HCl và có 2,688 lít H2 bay ra (ĐKTC). Mặt khác để hòa tan 6,4 gam oxit của kim loại B cũng cần dùng V ml dung dịch HCL trên. Xác định kim loại A và B

\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
PTHH: 2A + 2nHCl --> 2ACln + nH2
\(\dfrac{0,24}{n}\)<-0,24------------0,12
=> \(M_A=\dfrac{7,8}{\dfrac{0,24}{n}}=32,5n\left(g/mol\right)\)
Xét n = 1 => Loại
Xét n = 2 => MA = 65 (g/mol) => A là Zn
Xét n = 3 => Loại
PTHH: B2Om + 2mHCl --> 2BClm + mH2O
\(\dfrac{0,12}{m}\)<--0,24
=> \(M_{B_2O_m}=2.M_B+16m=\dfrac{6,4}{\dfrac{0,12}{m}}=\dfrac{160}{3}m\left(g/mol\right)\)
=> \(M_B=\dfrac{56}{3}m\left(g/mol\right)\)
Xét m = 1 => Loại
Xét m = 2 => Loại
Xét m = 3 => MB = 56 (g/mol)
=> B là Fe

\(n_{Fe_3O_4}=\dfrac{24}{232}=\dfrac{3}{29}\left(mol\right)\)
PTHH :
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
3/29 9/29
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
9/29 18/29
\(c,V_{HCl}=\dfrac{\dfrac{18}{29}}{1,5}=\dfrac{12}{29}\left(l\right)\)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)
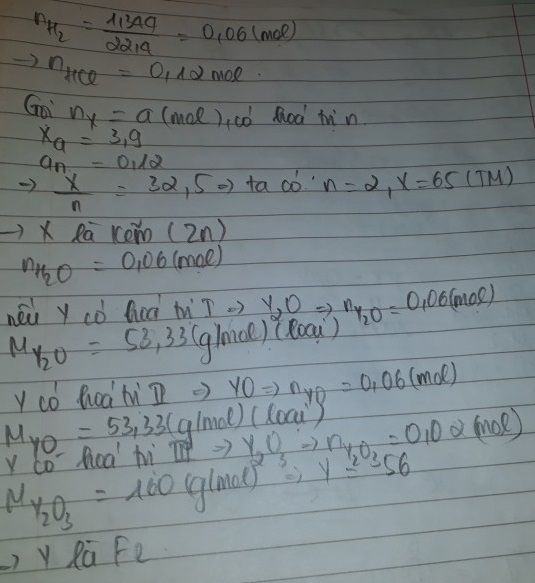
mik sửa lại đề : Để hòa tan 3,9g kim loại X cần dùng thể tích(ml) dd HCl và có 1,344 l H2 bay ra (đktc) . mặt khác để hòa tan 3,2g oxit kim loại Y cần dùng thể tích dd HCl ở trên . hỏi X,Y là kim loại gì ?
2X +2nHCl --> 2XCln +nH2 (1)
YxOy + 2yHCl --> xYCl2y/x + yH2 (2)
nX=3,9/MX (MOL)
nH2=0,06(mol)
theo (1): nX=2/n .nH2=0,12/n(mol)
=> 3,9/MX=0,12/n => MX=32,5n(g/mol)
Xét => X :Zn
nZn=0,06(mol)
nYxOy=3,2/xMY+16y(mol)
theo (2) : nYxOy=1/2y.nHCl=0,06/y(mol)
=> \(\dfrac{3,2}{xMY+16y}=\dfrac{0,06}{y}\)=> MY=\(\dfrac{56}{3}.\dfrac{2y}{x}\) (g/mol)
Xét => Y :Fe