Bài 3 : Cho m gam bột kẽm vào 2 lít dung dịch AgNO3 0,2 M . Sau một thơi gian lấy thanh kẽm ra cân được 28,1 g bột kim loại A , còn lại dung dịch B . Lấy A cho vào dung dịch HCl dư , thấy thoát ra 2,24 lít khí ( đktc ) . Xác đinh m và nồng độ mol / lít của các chất trong B . Biết thể tích dung dịch thay đổi không đáng kể .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

Đáp án A
Các thí nghiệm sinh ra kim loại sau phản ứng là : (1), (4)

Dung dịch M gồm : FeSO4 ,ZnSO4 và CuSO4 dư
Kết tủa gồm : Fe(OH)2 , Cu(OH)2 (Không còn Zn(OH)2 vì NaOH dư nên bị hòa tan hết).
Chất rắn N : Fe2O3(a mol) ; CuO(b mol)
\(\Rightarrow 160a + 80b = 20(1)\)
Chất rắn P :
Fe : \(n_{Fe} = 2n_{Fe_2O_3} = 2a(mol)\)
Cu : \(n_{Cu} = n_{CuO} = b(mol)\)
\(\Rightarrow 112a + 64b = 15,84(2)\)
Từ (1)(2) suy ra a = 0,01 ; b = 0,23
Bảo toàn nguyên tố với Fe,Cu :
\(n_{FeSO_4} = 2n_{Fe_2O_3} = 0,02(mol)\\ n_{CuSO_4} = n_{CuO} = 0,23(mol)\)
\(n_{ZnSO_4} = 2,5n_{FeSO_4} = 0,05(mol)\)
Zn + CuSO4 \(\to\) ZnSO4 + Cu
..0,05...0,05......................0,05.........(mol)
Trên thanh kẽm : \(m_{Cu} = 0,05.64 = 3,2(gam)\)
Fe + CuSO4 \(\to\) FeSO4 + Cu
0,02....0,02......................0,02.......(mol)
Trên thanh sắt : \(m_{Cu} = 0,02.64 = 1,28(gam)\)
\(n_{CuSO_4} = 0,05 + 0,02 + 0,23= 0,3(mol)\\ \Rightarrow C_{M_{CuSO_4}} = \dfrac{0,3}{0,15} = 2M\)
..

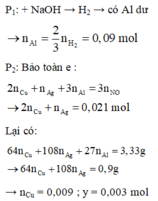
Trong 6,66g B có : 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe
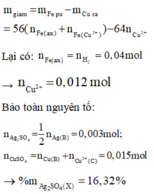
Đáp án A

Đáp án A
P1: + NaOH → H2 → có Al dư → n A l = 2 3 n H 2 = 0 , 09 m o l
P2: Bảo toàn e: 2 n C u + n A g + 3 n A l = 3 n N O → 2 n C u + n A g = 0 , 021 m o l
Lại có: 64 n C u + 108 n A g + 27 n A l = 3 , 33 g → 64 n C u + 108 n A g = 0 , 9 g
→ n C u = 0 , 009 ; y = 0 , 003 m o l
Trong 6,66g B có: 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe:
m g i ả m = m F e p ư - m C u r a = 56 ( n F e ( a x ) + n F e ( C u 2 + ) ) - 64 n C u 2 +
Lại có: n F e ( a x ) = n H 2 = 0 , 04 m o l → n C u 2 + = 0 , 012 m o l
Bảo toàn nguyên tố:
n A g 2 S O 4 = 1 / 2 n A g ( B ) = 0 , 003 m o l ; n C u S O 4 = n C u ( B ) + n C u ( C ) 2 + = 0 , 015 m o l
→ m A g 2 S O 4 ( X ) = 16 , 32 %

Bài 1
2Al+3CuSO4→Al2(SO4)3+3Cu
a-------------------------------------1,5a
Đặt a là số mol của Al pư
Độ tăng của thanh Al sau khi lấy thanh ra khỏi dd:
46,38−45=1,38(g)
⇒96a−27a=69a=1,38
⇒a=0,02⇒a=0,02
⇒mCu=1,92(g)
Câu 1:
2Al + 3Cu2+ --> 2Al3+ + 3Cu
x............1,5x.........................1,5x
m sau – m trước = 64 . 1,5x – 27x = 46,38 – 45
=> x = 0,02 => m Cu phản ứng = 1,5 . 0,02 . 64 = 1,92g
Câu 2:
mAgNO3 = 340 . 6% = 20,4g => nAgNO3 = 0,12mol
Khối lượng AgNO3 giảm 25% chính là lượng AgNO3 phản ứng
=> nAgNO3 phản ứng = 0,12 . 25% = 0,03
Cu + 2AgNO3 ---> Cu(NO3)2 + 2Ag
0,015..........0,03.....................................0,03
m vật = 15 + (0,03.108 - 0,015.64) = 17,28 (g)
@thuongnguyen: ủa thế cái dòng thứ 2 tính nAgNO3 chi vậy bạn ??