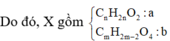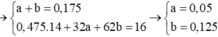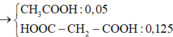có 96g khi oxi và 34 g khi amoniac NH3 .Nếu đem tropn65 hai khi vs nhau thì thu dc hỗn hợp khí có thể tich là bai nhieu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1/ a/ PTHH: 2Zn + O2 ===> 2ZnO
b/ Theo định luật bảo toàn khối lượng
=> mZn + mO2 = mZnO
c/ mO2 = mZnO - mZn = 1,63 - 1,3 = 0,33 gam2
2/
a/ PTHH: 3Fe + 2O2 ===> Fe3O4
b/ Áp dụng định luật bảo toàn khối lượng
=> mO2 = mFe3O4 - mFe = 23,2 - 16,8 = 6,4 gam
c/ Không hiểu đề bài!![]()
3/
=> nO2 = 96 / 32 = 3 mol
=> nNH3 = 34 / 17 = 2 mol
=> Vhỗn hợp khí = ( 3 + 2 ) x 22,4 = 112 lít
4/
a/ PTHH: 4Al + 3O2 ===> 2Al2O3
b/ Phương trình trên có 2 đơn chất , 1 hợp chất
c/ Áp dụng định luật bảo toàn khối lượng
=> mO2 = mAl2O3 - mAl = 40,8 - 21,6 = 19,2 gam

V nước = = 1250 - 550 = 700(ml)
V nio = 100(ml)
=> V CO2 = 550 - 250 = 300(ml)
Bảo toàn nguyên tố với N :
=> V NH3 = 2 V N2 = 200(ml)
=> V hidrocacbon = 300 -200 = 100(ml)
Ta có :
Số nguyên tử C = V CO2 / V hidrocacbon = 300/100 = 3
Khi đốt NH3, V H2O sinh ra = 3/2 V NH3 = 300(ml)
=> V H2O khi đốt hidrocacbon sinh ra = 700 -300 = 400(ml)
Số nguyên tử H = 2V H2O / V hidrocacbon = 400.2/100 = 8
Vậy CTPT của hidrocacbon là C3H8

Có phương trình cháy
4NH3+3O2->2N2+6H2O
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
Theo dữ kiện bài toán sau khi đốt cháy tạo 100 ml ni tơ
Thực tết thhu được thể tích N2 nhỏ hơn 2 lần hỗn hợp đầu
->V NH3 ban đầu là 100*2=200ml
->V CxHy ban đầu = 100ml
Sau khi đốt tạo 550-250=300 ml CO2
và 1250-550-300=400 ml nước
Có tỉ lệ
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
100------------------300--------400
->x=3
y=8
Vậy CT C3H8

Đáp án C
· X + HNO3 đặc, nóng, dư ® hỗn hợp 2 khí gồm NO2 (0,9 mol) và CO2
· Kết tủa thu được chỉ có BaSO4
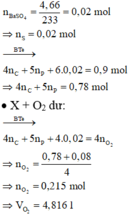

\(a.V_{NH_3}=0,8.22,4=17,92\left(l\right)\\ b.n_{N_2}=\dfrac{140}{28}=5\left(mol\right)\\ V_{N_2}=112\left(l\right)\\ n_{O_2}=\dfrac{96}{32}=3\left(mol\right)\\ V_{O_2}=22,4.3=67,2\left(l\right)\)
\(c.n_{hh}=0,5+0,2=0,7\left(mol\right)\\ V_{hh}=0,7.22,4=15,68\left(l\right)\\ d.m_{NH_3}=4,25\left(g\right)\\ n_{CO}=\dfrac{28}{22,4}=1,25\left(mol\right)\\ m_{CO}=1,25.28=35\left(g\right)\\ m_{hh}=4,25+35=39,25\left(g\right)\)
a. Thể tích của 0,8 mol khí NH3 (đktc)
=>VNH3=0,8.22,4=17,92l
b. Thể tích ở đktc của 140 g khí Nitơ ; 96g khí Oxi
nN2=140\14.2=5 mol
nO2=96\32=3 mol
=>Vhh=(5+3).22,4=179,2l
c. Thể tích của hỗn hợp khí gồm 0,5 mol Cl2 và 0,2 mol N2 ở điều kiện tiêu chuẩn.
=>Vhh=(0,5+0,2).22,4=15,68l
d. Khối lượng của hỗn hợp 0,25 mol khí NH3 , 28lit khí CO.
n CO=28\22,4=1,25 mol
=>mhh=0,25.17+1,25.28=39,25g

a) nN2 = \(\frac{14}{28}=0,5\left(mol\right)\)
VN2 = \(0,5.22,4=11,2\left(l\right)\)
b) nH2 = \(\frac{2}{2}=1\left(mol\right)\)
nNH3 = \(\frac{34}{17}=2\left(mol\right)\)
nhh = 2 + 1 = 3 (mol )
Vhh = 3 . 22,4 = 67,2 ( lít )

Ta có MX = 3,6.2 =7,2.
Áp dụng qui tắc đường chéo :
=> nH2 : nN2 = 4 : 1
Đặt nH2 = 4 mol => nN2 = 1 mol
N2 + 3H2 ---> 2NH3
x----->3x-------->2x
=> nY = 5 – 2x mol
Bảo toàn khối lượng :
mX = mY = 4.2 + 1.28 = 36g
=> MY = 4.2 = \(\dfrac{36}{5-2x}\)
=> x = 0,25 mol
Tính hiệu suất theo N2 => H = \(\dfrac{0,25}{1}\)= 25%