1. Đốt cháy hoàn toàn 3,36 lít hỗn hợp X (đktc) gồm CH4, C2H2, C2H4, C3H6, C4H10 thì thu được 12,32 lít CO2 (đktc), và 10,8 gam H2O.
a. Tính khối lượng hỗn hợp X .
b. Xác định tỉ khối của X so với H2 .
2. Đặt 2 chiếc cốc thủy tinh lên 2 đĩa cân và điều chỉnh cân thăng bằng, lấy a gam mỗi kim loại Al và Fe cho vào hai cốc đó, rồi rót từ từ vào hai cốc cùng một lượng dung dịch chứa b mol HCl. Tìm điều kiện giữa a và b để cân thăng bằng.

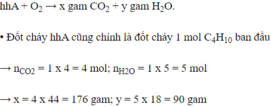
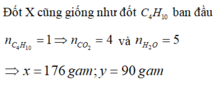
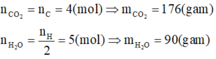
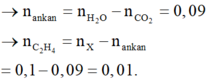


Câu 1 :
\(n_X=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{CO_2}=\dfrac{12.32}{22.4}=0.55\left(mol\right)\)
\(\Rightarrow n_C=0.55\left(mol\right)\)
\(n_{H_2O}=\dfrac{10.8}{18}=0.6\left(mol\right)\)
\(\Rightarrow n_H=0.6\cdot2=1.2\left(mol\right)\)
\(m_X=m_C+m_H=0.55\cdot12+1.2=7.8\left(g\right)\)
\(\overline{M}_X=\dfrac{7.8}{0.15}=52\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{X}{H_2}}=\dfrac{52}{2}=26\)
Câu 2 :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Al}=\dfrac{a}{27}\left(mol\right)\)
\(n_{Fe}=\dfrac{a}{56}\left(mol\right)\)
Để cân thăng bằng thì lượng khí H2 thoát ra phải như nhau.
Vì :
\(n_{Fe}=\dfrac{a}{56}< n_{Al}=\dfrac{a}{27}\left(mol\right)\)
và lượng H2 sinh ra ở cả 2 phản ứng trên phụ thuộc vào HCl là như nhau
Để cân thăng bằng thì lượng HCl cho vào không vượt quá lượng tối đa để hòa tan Fe
\(n_{HCl}=2n_{Fe}=\dfrac{2a}{56}\left(mol\right)\)
\(\Rightarrow b\le\dfrac{2a}{56}\)