Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặc điểm hợp chất ion:
+ Các hợp chất ion thường là tinh thể rắn ở điều kiện thường
+ Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao
=> Phát biểu (b) và (c) đúng
So sánh được tính chất vật lí giữa các phân tử dựa vào liên kết hydrogen và tương tác van der Waals.

Để so sánh được tính chất vật lí giữa các phân tử, chúng ta cần nắm được những ý sau:
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
⇒ Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
⇒ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.

Quy luật của sự biến đổi tính chất vật lí và độ âm điện của các halogen là:
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Màu sắc đậm dần.
- Độ âm điện giảm dần từ flo đến iot.
Quy luật của sự biến đổi tính chất vật lí và độ âm điện của các halogen là:
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Màu sắc đậm dần.
- Độ âm điện giảm dần từ flo đến iot.

Các hiện tượng có xuất hiện của liên kết hydrogen, tương tác van der Waals trong thực tiễn:
- Liên kết hydrogen: có trong DNA để tạo thành các chuỗi kép, hình thành cấu trúc chuỗi cấp trong các protein…
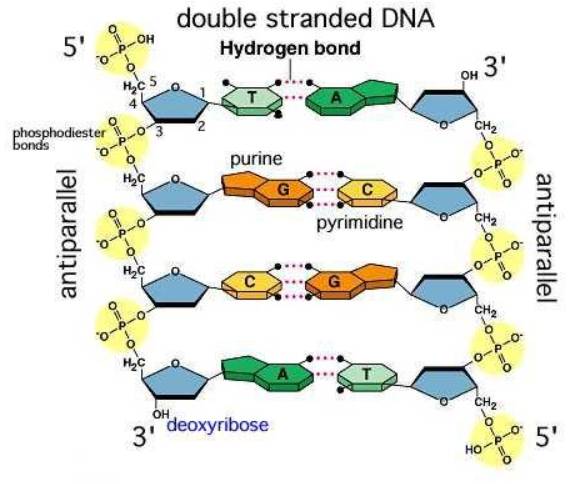
Liên kết hydrogen trong nước giúp duy trì sự ổn định chất lỏng trong một phạm vi diện rộng, làm cho băng đá nhẹ hơn nước lỏng bởi vậy băng nổi trên mặt nước, nước có thể bay hơi làm cho hệ sinh thái trên Trái Đất tuần hoàn tự nhiên.
- Lực tương tác van der Waals: sự bám hút của hạt bụi trên bề măt; tắc kè, thạch sùng có thể bám chắc trên các bề mặt trơn nhẵn; khả năng kết dính của băng dính; sự hấp phụ chất độc và phân tử màu trong nước bởi than hoạt tính…

Bởi vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các hợp chất ion đều khá rắn, khó bay hơn, khó nóng chảy.

Tìm phát biểu sai trong các phát biểu sau: *
A. HF có nhiệt độ nóng chảy và nhiệt độ sôi cao bất thường.
B. Từ HCl đến HI: nhiệt độ nóng chảy và nhiệt độ sôi tăng dần theo chiều tăng phân tử khối.
C. Hiđro halogenua tan rất nhiều trong nước.
D. Tất cả các hiđro halogenua đều là chất lỏng, không màu.
=> Hầu hết ở nhiệt độ thường , các hidro halogenua đều là chất khí
Tìm phát biểu sai trong các phát biểu sau: *
A. HF có nhiệt độ nóng chảy và nhiệt độ sôi cao bất thường.
B. Từ HCl đến HI: nhiệt độ nóng chảy và nhiệt độ sôi tăng dần theo chiều tăng phân tử khối.
C. Hiđro halogenua tan rất nhiều trong nước.
D. Tất cả các hiđro halogenua đều là chất lỏng, không màu.

Ở nhiệt độ phòng, có sự chuyển hóa từ vì vậy khi giữ SB → Sa vài ngày ở nhiệt độ phòng thì:
- Khối lượng riêng của lưu huỳnh tăng dần.
- Thể tích của lưu huỳnh giảm.

a) Tinh thể ion: Nacl; MgO; CsBr; CsCl
Tinh thể nguyên tử: Kim cương
Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit
b) So sánh nhiệt độ nóng chảy:
Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
– Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn.
Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là: tinh thể ion
Lực Van der Waals là một loại tương tác giữa các phần tử có tiếp xúc với nhau, được đặt tên của nhà vật lý người Hà Lan Johannes Diderik van der Waals, mô tả một loại tương tác phụ thuộc vào khoảng cách giữa các phần tử, công bố đầu tiên vào năm 1873. Các phần tử tham gia vào lực này thường là phân tử.
Thực chất, lực Van der Waals là lực tĩnh điện, thường xuất hiện giữa các phân tử chất khí, khí hóa lỏng hoặc hóa rắn, và trong hầu hết các chất lỏng và chất rắn hữu cơ.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
-Tương tác van der Waals làm tăng nhiệt độ sôi và nhiệt độ nóng chảy. ⟹ Khí hiếm có nhiệt độ nóng chảy thấp nhất là He và cao nhất là Xe.