Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Các phương trình phản ứng
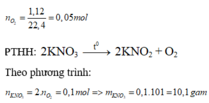
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

2KClO3\(\overset{t^0}{\rightarrow}2KCl+3O_2\)
2KNO3\(\overset{t^0}{\rightarrow}2KNO_2+O_2\)
b) Nếu dùng 0,1 mol mỗi chất thì:
+ Số mol O2 ở trường hợp 1 là 0,1.3:2=0,15mol
+Số mol O2 ở trường hợp 2 là; 0,1.1:2=0,05mol
c)Số mol O2=1,12:22,4=0,05mol
- Số mol KClO3=0,05.2:3\(\approx0,33mol\)
\(m_{KClO_3}=0,33.122,5=40,425g\)
Số mol KNO3=0,05.2=0,1 mol
\(m_{KNO_3}=0,1.101=10,1g\)
a) Các phương trình phản ứng phân hủy:
2KNO3 → 2KNO2 + O2 ↑ (1)
2KClO3 → 2KCl + 3O2 ↑ (2)
b) Theo phương trình (1) và (2): số mol hai muối tham gia phản ứng nhu nhau (0,1 mol), nhưng số mol oxi sinh ra không như nhau.
Theo phương trình (1): nO2 = 1/2 nKNO3 = 0,05 mol
VO2 = 1,12 lít
Theo phương trình (2): nO2 = 3/2 nKClO3 = 0,15 mol
VO2 = 0,15 .22,4 = 3,36 lít.
c) nO2 = 1,12 /22,4 =0,05 mol;
MKNO3 = 101; MKClO3 = 122,5
2KNO3 → 2KNO2 + O2
2KClO3 → 2KCl + 3O2
nKNO3 = 0,05 . 2 = 0,1 mol.
mKNO3 cần dùng = 0,1 x 101 = 10,1g
mKClO3 cần dùng = 2 x 0,05 /3 x 122,5 = 4,08g.

\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(nO_2=3.0,25=0,75\left(mol\right)\)
\(VO_2=0,75.22,4=16,8\left(l\right)\)
\(nCO_2=2.0,25=0,5\left(mol\right)\)
\(VCO_2=0,5.224=11,2\left(l\right)\)

Bài 1:
PTHH: \(CH_4+Cl_2\underrightarrow{a/s}CH_3Cl+HCl\)
Theo PTHH: \(n_{Cl_2}=n_{CH_3Cl}=n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CH_3Cl}=0,15\cdot50,5=7,575\left(g\right)\\V_{CH_4}=V_{Cl_2}=3,36\left(l\right)\end{matrix}\right.\)
Bài 2:
PTHH: \(CH_4+2O_2\underrightarrow{a/s}CO_2+2H_2O\)
Theo PTHH: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}\\n_{O_2}=2n_{CH_4}\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=V_{CH_4}=5,6\left(l\right)\\V_{CO_2}=2V_{CH_4}=11,2\left(l\right)\end{matrix}\right.\)

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,2 0,15 0,1
b) \(V_{O_2}=0,15.24,79=3,7185\left(mol\right)\)
c) \(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ a,4Al+3O_2\underrightarrow{^{to}}2Al_2O_3\\ 0,2.......0,15........0,1\left(mol\right)\\ b,V_{O_2\left(25^oC,1bar\right)}=24,79.0,15=3,7185\left(l\right)\\ c,m_A=m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
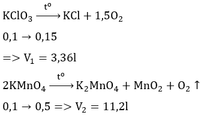
a,pthh :
2KClO3--->2KCl+3O2
2KNO3--->2KNO2+O2
Đ k: nhiệt độ
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
