K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

1 tháng 1 2020
Đáp án C
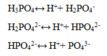 Vậy có tất cả số ion là: H+, H2PO4-, HPO42-, PO43-
Vậy có tất cả số ion là: H+, H2PO4-, HPO42-, PO43-

TB
1 tháng 11 2016
H3PO4 + K2HPO4 →2KH2PO4
H3PO4 + Ca(OH)2 →CaHPO4 +2H2O
2H3PO4 + 3Ca(OH)2 →Ca3(PO4)2 +6H2O

2 tháng 11 2016
a) \(4P+5O_2\rightarrow2P_2O_5\)
b) \(4H_2+Fe_3O_4\rightarrow3Fe+4H_2O\)
c) \(4Ca+6H_3PO_4\rightarrow2Ca_2\left(PO_4\right)_3+9H_2\)

Chọn C
Bỏ qua sự phân li của nước trong dung dịch có 3 anion là: H 2 PO 4 - , HPO 4 2 - , PO 4 3 - .