Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Ta có nH+=0.02, nOH-=0.04 nên sau phản ứng nOH- = 0,02 và V = 0,2
→ Cm OH- = 0,1 => pH = 1

Chọn A
Ta có nH2SO4 = 0,05.0,1 = 0,005 mol; nHCl = 0,1.0,1 = 0,01 mol
⇒ ∑nH+ = 2nH2SO4 + nHCl = 2.0,005 + 0,01 = 0,02 mol
nNaOH = 0,2.0,1 = 0,02 mol; nBa(OH)2 = 0,1.0,1 = 0,01 mol
⇒ ∑nOH- = nNaOH + 2nBa(OH)2 = 0,02 + 2.0,01 = 0,04 mol
Khi trộn axit với kiềm thì bản chất của phản ứng là:
H+ + OH- → H2O
(0,02) (0,04)
⇒ nOH-còn dư = 0,04 – 0,02 = 0,02 mol ⇒ [OH-] còn dư = 0,02/0,2 = 0,1M
⇒ Dung dịch X có pOH = - lg[OH-]còn dư = 1 ⇒ pH = 14 – 1 = 13

Chọn A
∑ nH+ = 2nH2SO4 + nHCl = 2. 0,1.0,05 + 0,1.0,1 = 0,02 (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 0,1.0,2 + 2. 0,1.0,1 = 0,04 (mol)
H+ + OH- → H2O
0,02 → 0,02
=> nOH- dư = 0,04 – 0,02 = 0,02 (mol)
=> [OH-] = n: V = 0,02 : 0,2 = 0,01 M
pH = 14 + log(OH-) = 14 + (-1) = 13

Chọn A
450 ml X do trộn 225 ml HCl và 225 ml H2SO4 => nH+ = 0,1125 mol
nOH = 0,2V (mol)
Do Z có pH = 1 (axit) => axit dư => nH+ dư = 10-pH.(0,45 + V) = 0,1125 – 0,2V
=> V = 0,225 lit
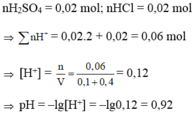
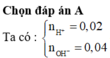
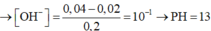

HD:
HA: 0,01 mol; NaOH: 0,005 mol.
Dung dịch B dư HA 0,005 mol.
HA \(\Leftrightarrow\) H+ + A-
bđ: 0,005 0 0
cb: 0,005-x x x
Ka = x2/(0,005-x) = 10-3,75.
Giải phương trình thu được x = 8,58.10-4 = [H+]. Do đó: pH = -log[H+] = 3,066.