Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1: đầu tiên nước dd brom mất màu sau đó xuất hiện kết tủa trắng
SO\(_2\)2 + Br2 = H2SO4 + HBr
H2SO4 + BaCl = HCl + BaSO4(kết tủa)
2: xuất hiện khí mùi khai
NaOH + NH4HCO3 = NaHCO3 + NH3(khí) + H2O
3: xuất hiện khí không màu
Cu + H2SO4 = CuSO4 + SO2 + H2O \(\rightarrow\)

- Ta có phương trình: 2HCl + Fe → FeCl2 + H2↑
=> Khi cho đinh sắt tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là hydrogen
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn

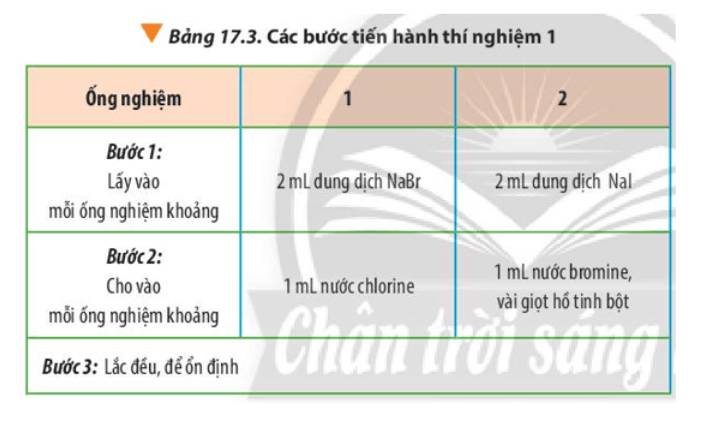
- Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt
- Ống nghiệm 2: dung dịch không màu chuyển thành vàng, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím

1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
- Chất oxi hóa CuSO4
- Chất khử Fe
* Thí nghiệm 2:
- Chất oxi hóa H2SO4
- Chất khử Fe

C
Hiện tượng: đồng tan cho dung dịch màu xanh, có bọt khí thoát ra không màu.
C u + 2 H 2 S O 4 đ ặ c → t ° C u S O 4 ( x a n h ) + S O 2 ( ↑ k h ô n g m à u ) + 2 H 2 O

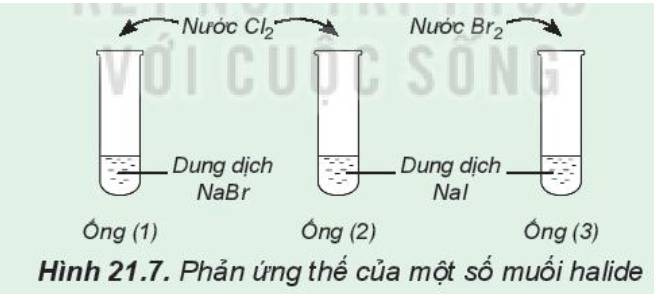
1:
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

1. Sự thay đổi màu sắc trong ống nghiệm được đung nóng nhanh hơn.
2. Khi nhiệt độ tăng, tốc độ phản ứng sẽ tăng lên
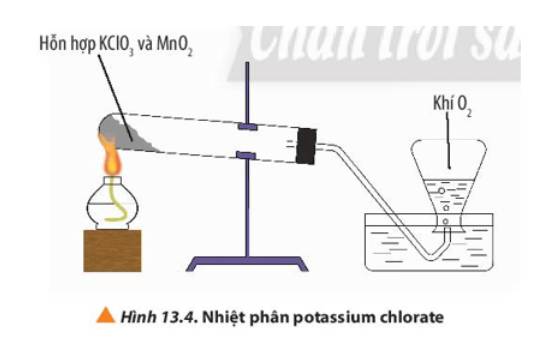
- Hiện tượng: Xuất hiện bọt khí nổi lên, đẩy nước ra khỏi bình tam giác
- Nếu ngừng đốt nóng, phản ứng dừng lại, khí không được sinh ra