Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1: đầu tiên nước dd brom mất màu sau đó xuất hiện kết tủa trắng
SO\(_2\)2 + Br2 = H2SO4 + HBr
H2SO4 + BaCl = HCl + BaSO4(kết tủa)
2: xuất hiện khí mùi khai
NaOH + NH4HCO3 = NaHCO3 + NH3(khí) + H2O
3: xuất hiện khí không màu
Cu + H2SO4 = CuSO4 + SO2 + H2O \(\rightarrow\)

Fe + H2SO4 → FeSO4 + H2↑
ZnO + H2SO4 → ZnSO4 + H2O
MgSO3 + H2SO4 → MgSO4 + SO2↑ + H2O
Y: FeSO4, ZnSO4, MgSO4
Z: H2, SO2
SO2 + Ca(OH)2 → CaSO3↓ + H2O
G: CaSO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2↓
2NaOH + MgSO4 → Na2SO4 + Mg(OH)2↓
Q: Fe(OH)2, Zn(OH)2, Mg(OH)2
R: Na2SO4
4Fe(OH)2 + O2 \(\underrightarrow{to}\) 2Fe2O3 + 4H2O
Zn(OH)2 \(\underrightarrow{to}\) ZnO + H2O
Mg(OH)2 \(\underrightarrow{to}\) MgO + H2O
T: Fe2O3, ZnO, MgO

1: \(AgNO_3+NaI\rightarrow NaNO_3+AgI\downarrow\)
\(AgNO_3+NaCl\rightarrow NaNO_3+AgCl\downarrow\)
\(AgNO_3+NaBr\rightarrow NaNO_3+AgBr\downarrow\)
2: nếu xuất hiện kết tủa trắng thì ống nghiệm đó là NaCl
nếu xuất hiện kết tủa vàng nhạt thì ống nghiệm đó là NaBr
nếu xuất hiện kết tủa vàng đậm thì ống nghiệm đó là NaI
nếu ko xuất hiện kết tủa thì ống nghiệm đó là NaF

gọi số mol của hỗn hợp muối là \(\begin{cases}X_2CO_3:2x\\XHCO_3:2y_{ }\\XCl:2z\end{cases}\)
gọi số mol HCl : a mol
ptpu : X2CO3 + 2HCl = 2XCl + CO2 + H2O
XHCO3 + HCl = XCl + CO2 + H2O
khí B : CO2 có số mol = 0,4 mol = 2x + 2y (1)
dd A gồm : \(\begin{cases}XCl:2\left(2x+y+z\right)\\HCl_{dư}=a-4x-2y\end{cases}\)
Phần 1 : hh A + AgCl = kết tủa
kết tủa ở đây chính là AgCl => số mol AgCl = 0,48 mol
=> z + \(\frac{a}{2}\)=0,48 => a = (0,48 -z) / 2 (2)
Phần 2 : nKOH = 0,1 = \(\frac{1}{2}\)nHCl dư => a -4x -2y = 0,2 (3)
hốn hợp muối gồm : \(\begin{cases}XCl:2x+y+z\\KCl:0,1\end{cases}\)
m hỗn hợp muối = 29,68 = (2x + y+z) .(X+35,5) = 29,68 -39.0,1 = 22,23 (4)
từ (2) thay vào (3) => (2x + y +z) = 0,38 (5)
từ (5) thay vào (4) ta tìm được X = 23 => X là Na
Đến đây bạn tự giải câu b nhé

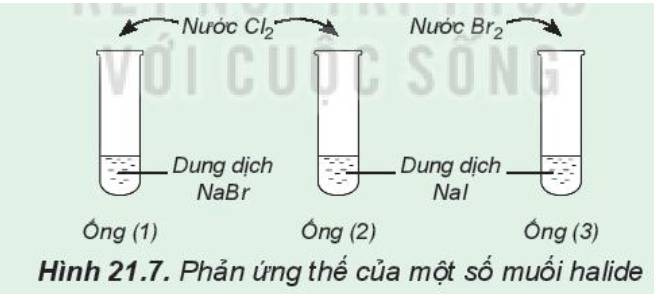
1:
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

p+e+n=34
p=e
2p+n=34
2p=10+n
p=11 n=12 A=23
b, z=p=e=16 n=16
c,tinh phi kim

Ta có : Sau khi các phản ứng hoàn thành thu được chất rắn cuối cùng là Fe2O3 .
Ta có : \(\left\{{}\begin{matrix}n_{FeO}=0,4\left(mol\right)\\n_{Fe_2O_3}=0,1\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{\left(Fe\right)}=0,4\left(mol\right)\\n_{\left(Fe\right)}=2n_{Fe_2O_3}=0,2\left(mol\right)\end{matrix}\right.\)
=> \(n_{\left(Fe\right)}=0,4+0,2=0,6\left(mol\right)\)
=> \(n_{Fe_2O_3}=\frac{1}{2}n_{\left(Fe\right)}=\frac{1}{2}0,6=0,3\left(mol\right)\)
=> \(m_{Fe_2O_3}=n.M=0,3.160=48\left(g\right)\)