Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ống nghiệm 1 :
- Hiện tượng : Xuất hiện kết tủa trắng
- Giải thích : Do có muối AgCl tạo thành
- PTHH : \(NaCl + AgNO_3 \to AgCl + NaNO_3\)
Ống nghiệm 2 :
- Hiện tượng : Xuất hiện kết tủa vàng nhạt
- Giải thích : Do có muối AgBr tạo thành
- PTHH : \(NaBr + AgNO_3 \to AgBr + NaNO_3\)
Ống nghiệm 3 :
- Hiện tượng : Xuất hiện kết tủa vàng đậm
- Giải thích : Do có muối AgI tạo thành
- PTHH : \(NaI + AgNO_3 \to AgI + NaNO_3\)
Ống nghiệm 1 :
- Hiện tượng : Xuất hiện kết tủa trắng
- Giải thích : Do có muối AgCl tạo thành
- PTHH : NaCl+AgNO3→AgCl+NaNO3NaCl+AgNO3→AgCl+NaNO3
Ống nghiệm 2 :
- Hiện tượng : Xuất hiện kết tủa vàng nhạt
- Giải thích : Do có muối AgBr tạo thành
- PTHH : NaBr+AgNO3→AgBr+NaNO3NaBr+AgNO3→AgBr+NaNO3
Ống nghiệm 3 :
- Hiện tượng : Xuất hiện kết tủa vàng đậm
- Giải thích : Do có muối AgI tạo thành
- PTHH : NaI+AgNO3→AgI+NaNO3NaI+AgNO3→AgI+NaNO3
Đọc tiếp

CuO + H2SO4 => CuSO4 + H2O
CuSO4 + 2NaOH => Cu(OH)2 + Na2SO4
Cu(OH)2 + H2SO4 => CuSO4 + 2H2O
Hiện tượng: ban đầu, chất rắn màu đen tan dần, xuất hiện dung dịch màu xanh, cho NaOH vào ống nghiệm, màu xanh dung dịch nhạt dần, xuất hiện kết tủa xanh, nhỏ H2SO4l lần nữa, kết tủa xanh tan dần thành dung dịch màu xanh

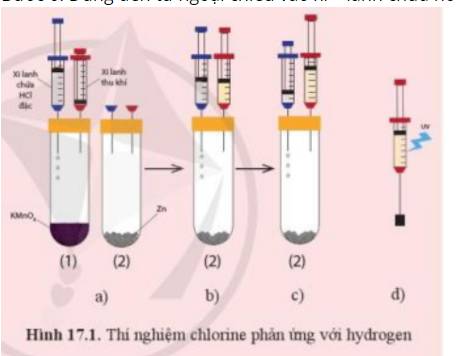
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI

- Ta có phương trình: HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Nồng độ HCl càng cao thì tốc độ phản ứng diễn ra càng nhanh.
- Giải thích: để phản ứng xảy ra, cần phải có sự va chạm giữa HCl và CaCO3. Ở ống nghiệm 2, nồng độ HCl lớn gấp đôi ở ống nghiệm 1, do vậy số va chạm của HCl và CaCO3 (trong cùng 1 đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng ở ống nghiệm 2 là lớn hơn

ống (1): hạt kẽm tan dần và có khí thoát ra
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
ống (2): ko có hiện tượng gì do Hcl ko tác dụng được với Cu
Hiện tượng : Viên kẽm tan dần, xuất hiện bọt khí không màu không mùi
Giải thích : Do kẽm phản ứng với HCl, sinh ra khí H2
PTHH : \(Zn + 2HCl \to ZnCl_2 + H_2\)