
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)

a) Số oxi hoá của cacbon trong :
\(CO\Rightarrow C^{+2}\)
\(CO_2\Rightarrow C^{+4}\)
\(C_2H_5OH\Rightarrow C^{-2}\)
\(CH_4\Rightarrow C^{-4}\)
b) Số oxi hoá của oxi trong :
\(O_2\Rightarrow O^0\)
\(O_3\Rightarrow O^0\)
\(H_2O\Rightarrow O^{-2}\)
\(H_2O_2\Rightarrow O^{-1}\)
c) Số oxi hoá của nitơ trong :
\(NO\Rightarrow N^{+2}\)
\(N_2\Rightarrow N^0\)
\(C_2N_2\Rightarrow N^{-3}\)
\(N_2O\Rightarrow N^{+1}\)

a) \(1s^22s^22p^63s^23p^63d^{10}4s^24p^4\)
b) \(1s^22s^22p^63s^23p^64s^1\)
c) \(1s^22s^22p^63s^2\)
d) \(1s^22s^22p^63s^23p^63d^64s^2\)
e) \(1s^22s^22p^63s^23p^63d^{10}4s^24p^5\)

Lưu huỳnh tác dụng với axit sunfuric đặc nóng :
S + H2SO4 -> 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số lưu huỳnh bị oxi hóa là
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.

Đặt X là số oxi hoá của nguyên tố ni tơ trong các hợp chất trên ta có
Trong NO: x + (-2) = 0 -> X = +2
Trong NO2: x + 2(-2) = 0 -> x = +4
Trong N2O5 : 2x + 5(-2) = 0 \(\rightarrow\) x = +5
Trong HNO3 : (+1) + x + 3(-2) = 0 \(\rightarrow\) X = +5
Trong HNƠ2 : (+1) + x + 2(-2) = 0 \(\rightarrow\) X = +3
Trong NH3 : X + 3(+l) = 0 \(\rightarrow\) X = -3
Trong NH4Cl: X + 4(+l) + (-1) = 0 \(\rightarrow\) X = -3.
Cũng giải tương tự như trên ta có:
.jpg)
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2(-2) = 0 → x = +4.
Trong N2O5: 2x + 5(-2) = 0 → x = +5.
Trong HNO3: (+1) +x + 3(-3) = 0 → x = +5.
Trong HNO2: (+1) + x +2(-2) = 0 → x = +3.
Trong NH3 : x + 3(+1) = 0 → x = -3.
Trong NH3Cl: x + 4(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!
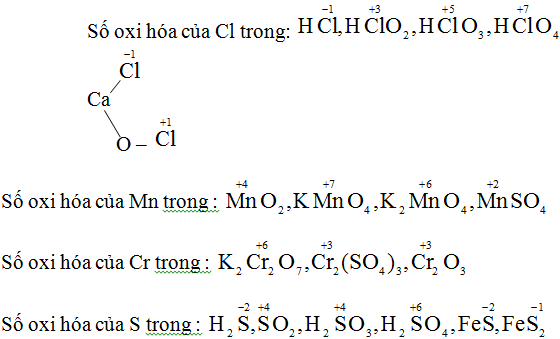
Đáp án đúng : C