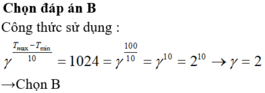Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.E_r=839,0+2\cdot418,4+2\cdot432,0=2539,8kJ\\ b.E_p=343,3+6\cdot418,4=2853,7kJ\\ c.\Delta_rH^{^{ }0}=2539,8-3197=-313,9kJ\cdot mol^{-1}\\ \Delta H< 0:pư.thu.nhiệt\)
\(a.E_{reactants}=839,0+2\cdot432,0=1703kJ\\ b.E_{products}=343,3+6\cdot432,0=2935,3kJ\\ c.\Delta_rH^{^o}_{298}=E_r-E_p=1703-2935,3=1232,3kJ\cdot mol^{^{ }-1}.\)
\(\Delta H< 0\) => Phản ứng (1) thu nhiệt

Đáp án C
1. Sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
=> Đáp án C

1. sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
Đáp án C

Khi tăng nhiệt độ của bình phản ứng cân bằng hoá học của phản ứng sẽ chuyển dịch về phía nghịch, vì phản ứng thuận toả nhiệt.

Fe2O3 + 2Al → 2Fe + Al2O3
Phản ứng làm tăng nhiệt độ môi trường xung quanh, tỏa nhiệt lớn, lên đến 2500 oC

Chọn B
∆ H > 0 phản ứng thuận thu nhiệt.
(1) Tăng nhiệt độ của phản ứng cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều thuận.
(2) Tăng áp suất chung của hệ không làm ảnh hưởng đến cân bằng do số mol khí ở hai vế của phương trình hóa học bằng nhau.
(3) Giảm nhiệt độ của phản ứng cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt tức chiều nghịch.
(4) Tăng số mol CO cân bằng chuyển dịch theo chiều làm giảm CO tức chiều thuận.
→ Vậy có hai biện pháp (1) và (4) làm tăng hiệu suất của hệ phản ứng.

a.Do \(\Delta H>0\) nên đây là phản ứng thu nhiệt.
-Phản ứng thuận là phản ứng thu nhiệt.
b.
-Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều nghịch.
-Khi tăng nồng độ CO2, cân bằng dịch chuyển theo chiều nghịch.