

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



nCa(OH)2 = 0,15(mol)
nSO2=0,2(mol)
Ta có: 1< nCa(OH)2/nSO2<2
=> Sp thu được hh 2 muối CaSO3 và Ca(HSO3)2
PTHH: Ca(OH)2 + SO2 -> CaSO3 + H2O (1)
CaSO3 + SO2 + H2O -> Ca(HSO3)2 (2)
Ta có: nSO2(2)= 0,2-0,15=0,05(mol)
=> nCaSO3(2)=0,05(mol)
nCaSO3(1)=nCa(OH)2=0,15(mol)
=>m(kết tủa)= mCaSO3(còn)= (0,15-0,05).120=12(g)
=> Chọn B

\(n_{CO_2}=0,3\left(mol\right);n_{OH^-}=0,4\left(mol\right)\)
Lập T : \(\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,4}{0,3}=1,33\) => Tạo 2 muối BaCO3 và Ba(HCO3)2
Gọi BaCO3 (x_mol) , Ba(HCO3)2 (y_mol)
Ta có : \(\left\{{}\begin{matrix}x+y=0,2\left(BTNT:Ba\right)\\x+2y=0,3\left(BTNT:C\right)\end{matrix}\right.\)
=> x= 0,1 ;y=0,1
=> \(m_{BaCO_3}=0,1.197=19,7\left(g\right)\)
=> Chọn A
Sục 6,72 lít khí CO2 (đktc) vào 200 ml dung dịch Ba(OH)2 1M. Khối lượng kết tủa thu được sau phản ứng là bao nhiêu gam?
A. 19,7 gam.
B. 39,4 gam.
C. 59,1 gam.
D. 78,8 gam.


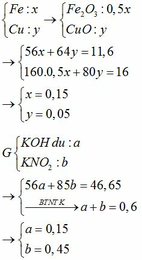
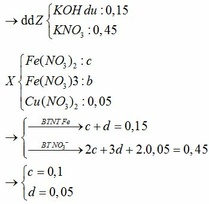

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

9
nSO2 = 4,48 : 22,4 = 0,2 (mol) ; nNaOH = 16: 40 = 0,4 (mol)
Ta thấy nNaOH/ nSO2 = 2 => chỉ tạo muối Na2SO3
=> mNa2SO3 = 0,2. 126 = 25, 2(g) =>D
10
nBa(OH) = 0,15.1 = 0,15mol; nBaCO3 = 19,7 : 197 = 0,1mol
Vì nBaCO3 < nBa(OH)2 → xét 2 trường hợp
Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1
Vậy V = VCO2 = 0,1.22,4 =2,24
Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat
CO2 + Ba(OH)2→ BaCO3 + H2O (1)
0,1 0,1 0,1
2CO2+Ba(OH)2→Ba(HCO3)2
0,1 0,05
Theo phương trình (1): nBa(OH)2(1) = nBaCO3=0,1mol
Mà nBa(OH)2= 0,15mol →nBa(OH)2 (2) = 0,15−0,1 = 0,05mol
Theo (1) và (2): nCO2 = nBaCO3 + 2nBa(OH)2 (2) = 0,1 + 2.0,05 = 0,2 mol
Vậy V = VCO2 = 0,2.22,4 = 4,48 lít
=>A

a, Ta có : \(n_{CO2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(BTNT\left(C\right):n_{MgCO3}=n_{CO2}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCO3}=n.M=8,4\left(g\right)\)
\(\Rightarrow m_{MgO}=8\left(g\right)\)
b, Thấy sau khi phản ứng xảy ra thu được dung dịch A gồm \(MgSO_4\) và có thể còn \(H_2SO_4\) dư .
\(BTNT\left(Mg\right):n_{MgSO_4}=n_{MgCO3}+n_{MgO}=0,3\left(mol\right)\)
\(PTHH:MgSO_4+Ba\left(OH\right)_2\rightarrow Mg\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
.................0,3............0,3..................0,3..................0,3.............
\(\Rightarrow m_{\downarrow}=m_{Mg\left(OH\right)2}+m_{BaSO4}=87,3\left(g\right)\)
Mà \(\left\{{}\begin{matrix}m\downarrow=110,6\left(g\right)>87,3g\\n_{Ba\left(OH\right)2}=C_M.V=0,45>n_{Ba\left(OH\right)2pu}\left(0,3mol\right)\end{matrix}\right.\)
=> Dung dịch A vẫn còn H2SO4 dư và mol BaSO4 được tạo ra tiếp là :
\(n_{BaSO4}=\dfrac{110,6-87,3}{M}=0,1\left(mol\right)\)
\(PTHH:H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
..................0,1............0,1...............0,1........................
Lại có : \(n_{Ba\left(OH\right)2}=0,45\left(mol\right)\)
=> Trong dung dịch B còn có Ba(OH)2 dư ( dư 0,45 - 0,3 - 0,1 = 0,05mol)
\(\Rightarrow C_{MBa\left(OH\right)2}=\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Vậy ...