Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn:
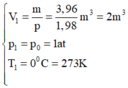
+ Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ:


Bài giải:
+ Trạng thái 1:
p1 = (760 – 314) mmHg
T1 = 273 + 2 = 275 K
V1 = mp1mp1
Trạng thái 2:
p0 = 760 mmHg
T0 = 273 K
\(V=\dfrac{m}{p_0}\)
Phương trình trạng thái:
\(\dfrac{poVo}{T_0}=\dfrac{p_1V_1}{T_1}\Rightarrow\dfrac{p_0.m}{p_0T_0}=\dfrac{p_1.m}{p_1.T_1}\)
\(\Rightarrow p_1=\dfrac{p_1p_0T_0}{p_0T_1}=\dfrac{446.1,29.273}{760.275}\)
p1 = 0,75 kg/m3

Khi lên cao thêm 10m thì áp suất khí quyển giảm 1mmHg vậy lên 3140m giảm 3140/10=314 mmHg
Từ PV/T= const ta có:
P1V1/T1=P2V2/T2
mà V=m/D.thay vào ta được:
P1m/T1D1 = P2m/T2D2 =>D2=P2T1D1/P1T2
thay số vào:
D2 = (446x273x1,29)/(760x275) =0,75Kg/m^3

Chọn A.
Ở điều kiện chuẩn p1 = 760 mmHg; ρ = 1,29 kg/m3.
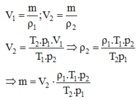
là khối lượng khí bơm vào bình sau nửa giờ.
khối lượng bơm vào sau mỗi giây:
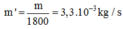

Chọn A.
Ở điều kiện chuẩn p 1 = 760 mmHg; ρ = 1,29 kg/ m 3 .


Biết ρ 0 = m/ V 0 và ρ = m/V ⇒ ρ 0 V 0 = ρ V
Mặt khác p 0 V 0 = pV
(vì nhiệt độ của khí bằng nhiệt độ ở điều kiện chuẩn).
Từ (1) và (2) suy ra:
ρ = ρ 0 p/ p 0 = 1,43.150/1 = 214,5(kg/ m 3 )
Và m = 214,5. 10 - 2 = 2,145 kg.

Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
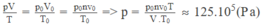
Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn: { V 1 = m p = 3 , 96 1 , 98 m 3 = 2 m 3 p 1 = p 0 = 1 a t T 1 = 0 0 C = 273 K
Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ { V 2 = 0 , 04 m 3 p 2 = 60 a t T 2 = ?
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ T 2 = p 2 V 2 T 1 p 1 V 1 = 60.0 , 04.273 1.2 T 2 = 327 , 6 K
Mà T 2 = 273 + t 2 = 327 , 6 K ⇒ t 2 = 54 , 6 0 C